题目内容
10.用相应的数字和化学符号填空.(1)两个镁离子2Mg2+
(2)两个氢分子2H2
(3)四个磷原子4P
(4)三个氢氧根离子3OH-
(5)m个水分子mH2O
(6)质子数为17的阴离子Cl-
(7)核电荷数为10的原子Ne
(8)质子数为18的分子HCl(合理即可).
分析 (1)离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其离子符号前加上相应的数字.
(2)分子的表示方法,正确书写物质的化学式,表示多个该分子,就在其分子符号前加上相应的数字.
(3)原子的表示方法,用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字.
(4)离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其离子符号前加上相应的数字.
(5)分子的表示方法,正确书写物质的化学式,表示多个该分子,就在其分子符号前加上相应的数字.
(6)氯离子是质子数为17的阴离子,写出其离子符号即可.
(7)氖原子是核电荷数为10的原子,写出其原子符号即可.
(8)氯化氢分子是质子数为18的分子,写出其分子符号即可.
解答 解:(1)由离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其离子符号前加上相应的数字,故两个镁离子可表示为:2Mg2+.
(2)由分子的表示方法,正确书写物质的化学式,表示多个该分子,就在其分子符号前加上相应的数字,则2个氢分子可表示为:2H2.
(3)由原子的表示方法,用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字,故4个磷原子表示为:4P.
(4)由离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其离子符号前加上相应的数字,故3个氢氧根离子可表示为:3OH-.
(5)由分子的表示方法,正确书写物质的化学式,表示多个该分子,就在其分子符号加上相应的数字,则m个水分子可表示为:mH2O.
(6)氯离子是质子数为17的阴离子,其离子符号为:Cl-.
(7)氖原子是核电荷数为10的原子,其原子符号为:Ne.
(8)氯化氢分子是质子数为18的分子,其分子符号为HCl(合理即可).
故答案为:(1)2Mg2+;(2)2H2;(3)4P;(4)3OH-;(5)mH2O;(6)Cl-;(7)Ne;(8)HCl(合理即可).
点评 本题难度不大,掌握常见化学用语(原子符号、分子符号、离子符号等)的书写方法是正确解答此类题的关键.

| A. | 化学变化都遵循质量守恒定律,所以质量不发生改变的变化就是化学变化 | |
| B. | 化合物是由多种元素组成的纯净物,所以由多种元素组成的纯净物一定是化合物 | |
| C. | 最外层达8电子的微粒化学性质稳定,因此化学性质稳定的微粒最外层电子数都是8 | |
| D. | 燃烧是发光、放热的变化,所以有发光、放热现象的变化一定是燃烧 |
| A. | HNO3 Ca(OH)2 NaCl | B. | KNO3 CuCl2 Na2SO4 | ||
| C. | NaOH MgSO4 BaCl2 | D. | HCl Na2CO3 Ca(NO3)2 |
| A. | 食醋与纯碱混合产生大量的气泡 | |
| B. | 鸡蛋清倒入开水中产生黄色固体 | |
| C. | 光亮的铜片在火焰上灼烧表面变黑 | |
| D. | 铁钉在潮湿的空气中生成红棕色铁锈 |

(1)实验l 中,两支试管的溶液都变成红色.
(2)实验2中,若B 盛装的是NaOH 溶液,发生反应的化学方程式为:2NaOH+CuSO4═Cu(OH)2↓+Na2SO4.
(3)实验3中,李红同学向两支试管吹气,A 中有白色沉淀生成,发生反应的化学方程式为:Ca(OH)2+CO2═CaCO3↓+H2O.
B 中无现象,为了探究吹气后B 中溶质的成分,李红进行了如下探究.
【提出猜想】:
猜想1:溶质只有氢氧化钠
猜想2:溶质只有碳酸钠
猜想3:溶质有氢氧化钠和碳酸钠.
【实验和结论】:
| 实验 | 实验现象 | 结论 |
| 取B 中少量溶液,加人澄清石灰水至不再 产生沉淀为止,过滤后取上层清液, 向其中加几滴酚酞试液. | 产生白色沉淀 溶液呈现红色 | 猜想3成立 |
同学们相互讨论后,李红得出的结论不正确(填“正确”或“不正确”),其原因是猜想2(填数字)也会产生相同的现象.
 某化学兴趣小组对一包干燥的红色粉末组成进行探究,该红色粉末可能由Cu、Fe2O3两种固体中的一种或两种组成.
某化学兴趣小组对一包干燥的红色粉末组成进行探究,该红色粉末可能由Cu、Fe2O3两种固体中的一种或两种组成.【提出猜想】红色粉末可能是:①Cu ②Fe2O3 ③Cu和Fe2O3
【查阅资料】(1)白色无水CuSO4遇水变蓝
(2)Cu在FeCl3溶液中发生反应:2FeCl3+Cu═2FeCl2+CuCl2
【实验探究】
[甲组同学]:定性检测该红色粉末的物质组成
(1)小云取少量红色粉末于试管中,滴加足量稀盐酸,充分振荡后观察,发现固体全部溶解,得有色溶液.则猜想猜想①一定不成立一定不成立,其中一定发生反应的化学方程式为Fe2O3+6HCl=2FeCl3+3H2O.
(2)小伟向小云得到的有色溶液中插入一根洁净的铁丝,反应充分后,观察到铁丝表面有红色物质生成
现象,得出猜想③成立.
[乙组同学]:定量测定该红色粉末中氧化铁的质量分数
实验步骤:小晨称取该红色粉末5.0g装入硬质玻璃管中,按如图进行实验.开始时缓缓通入CO气体,过一段时间后再高温加热使其充分反应.待反应完全后,停止加热,仍继续通CO气体直至玻璃管冷却.反应前后称量相关物质的总质量(装置内空气中的水蒸气、CO2忽略不计),其数据如下表:
| 反应前 | 反应后 | |
| Ⅰ 组 | 玻璃管和红色粉末的总质量为48.3g | 玻璃管和固体物质的总质量为47.1g |
| Ⅱ 组 | 洗气瓶和瓶中所盛物质的总质量为258.6g | 洗气瓶和瓶中所盛物质的总质量为261.91g |
(1)在装置A中先通CO气体的目的是排尽玻璃管内的空气.A装置中发生反应的化学方程式为3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(2)根据上述表格中的实验数据计算:红色粉末中氧化铁的质量分数为80%.
(3)从环保角度看上述装置有严重不足之处.你认为应该如何改进?缺少尾气处理装置;可以在导管口放点燃酒精灯,将一氧化碳烧掉.
【拓展延伸】对实验后B装置洗气瓶内溶液中是否有NaOH 剩余做进一步探究
实验步骤:小渊同学取该洗气瓶内溶液50克,逐滴加入质量分数为7.3%的稀盐酸至无气泡冒出为止,共用去稀盐酸60克,所得溶液质量为107.8克.试通过计算说明实验后B装置洗气瓶内溶液中是否有NaOH?(写出计算过程).
 如图试管中盛放的是室温时的硝酸钾、氯化钠、熟石灰的饱和溶液中的一种,现向烧杯内加入硝酸铵晶体,试管中立即有大量的晶体析出,则试管中盛放的溶液的溶质是( )
如图试管中盛放的是室温时的硝酸钾、氯化钠、熟石灰的饱和溶液中的一种,现向烧杯内加入硝酸铵晶体,试管中立即有大量的晶体析出,则试管中盛放的溶液的溶质是( )| A. | 硝酸钾 | B. | 氯化钠 | C. | 氯化氢 | D. | 熟石灰 |
 钢铁的冶炼是人类文明的一个重要标志,如图是模拟炼铁的实验装置图.
钢铁的冶炼是人类文明的一个重要标志,如图是模拟炼铁的实验装置图.
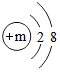 ,其微粒符号可表示为X2,则m的值为8.
,其微粒符号可表示为X2,则m的值为8.