题目内容
12.根据实验装置图,回答下列问题:
①用过氧化氢溶液和二氧化锰混合制取氧气应选用的发生装置是B,此反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;若在实验室收集二氧化碳气体应选择的装置是E,采用此收集方法的原因是二氧化碳的密度大于空气,且能溶于水.
制取二氧化碳的化学方程式CaCO3+2HCl=CaCl2+CO2↑+H2O.
②如装置F所示,点燃两支短蜡烛,然后沿烧杯内壁倾倒二氧化碳时,看到F中的实验现象蜡烛由下至上依次熄灭;证明CO2具有密度大于空气,不能燃烧且不支持燃烧的性质.
③某同学选用 G装置进行实验,看到与上一步实验F中完全相同的实验现象,他由此得出与上一步实验完全相同的结论.此结论不合理(答“合理”或“不合理”)
分析 ①据用过氧化氢溶液和二氧化锰混合制取氧气,不需加热,属于固液常温型,据反应原理书写方程式;据制取二氧化碳的反应物的状态和反应条件选择发生装置,并据二氧化碳的密度和溶解性选择收集装置,据反应原理书写方程式;
②根据装置F中,沿烧杯内壁倾倒二氧化碳时,看到的实验现象是:下面的蜡烛先熄灭,上面的蜡烛后熄灭;证明CO2具有的性质是:既不能燃烧也不能支持燃烧、密度比空气大解答;
③选用G装置进行实验,实验现象是:下面的蜡烛先熄灭,上面的蜡烛后熄灭;因此得出的结论与F装置相同解答.
解答 解:
①用过氧化氢溶液和二氧化锰混合制取氧气,不需加热,属于固液常温型,不需要加热,故选发生装置B;过氧化氢在二氧化锰的催化作用下生成水和氧气,反应的化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
实验室用大理石和稀盐酸常温反应制取二氧化碳,反应的方程式为:CaCO3+2HCl=CaCl2+CO2↑+H2O;二氧化碳的密度比空气大且能溶于水,故只能用向上排空气法收集;
②装置F中,沿烧杯内壁倾倒二氧化碳时,看到的实验现象是:下面的蜡烛先熄灭,上面的蜡烛后熄灭;证明CO2具有的性质是:二氧化碳既不能燃烧也不能支持燃烧;二氧化碳的密度比空气大;
③选用G装置进行实验,实验现象是:下面的蜡烛先熄灭,上面的蜡烛后熄灭;
但比较两个实验可以发现:气体进入的方向不一样,F装置中气体从上面进入,G装置中气体直接从下面开始.所以即使看到下面的蜡烛先熄灭,也无法断定密度比空气大;
故答案为:①B;2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;CaC03+2HCl=CaCl2+H2O+CO2↑;E;二氧化碳的密度大于空气,且能溶于水;
②蜡烛由下至上依次熄灭;密度大于空气,不能燃烧且不支持燃烧;
③不合理.
点评 本题考查知识比较基础,掌握实验室制取气体的装置选取方法,反应原理、二氧化碳的性质即可轻松作答,并能结合题目情景灵活分析解答相关问题.

 某学习小组探究氢氧化钙溶液的化学性质,并做了延伸探究.
某学习小组探究氢氧化钙溶液的化学性质,并做了延伸探究.探究一:甲同学设计了如下实验方案,请你帮助完成实验报告.
| 方案 | (1) | (2) | (3) |
| 实验操作 | 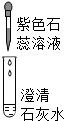 | 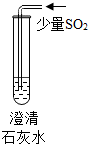 |  |
| 现象 | 溶液变为蓝色 | 澄清石灰水变浑浊 | 红色褪为无色 |
| 结论或解释 | 氢氧化钙溶液能使石蕊等酸碱指示剂变色 | 氢氧化钙溶液能与某些非金属氧化物反应生成盐和水.二氧化硫与澄清石灰水反应的化学方程式是 SO2+Ca(OH)2═CaSO3↓+H2O | 氢氧化钙溶液能与酸发生中和反应 |
【查阅资料】CaCl2溶液呈中性.
【作出猜想】乙同学从反应情况分析,溶液中除含少量酚酞外,溶质可能有以下三种情况:
①CaCl2;②CaCl2和HCl;③CaCl2和Ca(OH)2
【分析讨论】丙同学从实验现象分析得出:猜想③肯定不合理,其理由是稀盐酸加入滴有酚酞的石灰水中,红色褪为无色,说明溶液为中性或酸性,不可能有氢氧化钙.
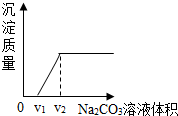
探究二:丁同学为进一步验证乙同学的猜想,设计实验如下:将实验方案(3)褪色后溶液倒入烧杯中,向其中逐滴滴加稀碳酸钠溶液至过量,边滴边振荡.实验后得出产生沉淀质量与滴加碳酸钠溶液体积之间的关系,如图所示.写出实验过程中的现象滴加碳酸钠溶液,开始先产生气泡,随后才产生沉淀,溶液最终变红色.
【得出结论】乙同学的猜想中,②(填序号)合理.
【反思讨论】
学习小组结合图象,分析了丁同学实验过程中烧杯内溶液的变化.下列说法正确的是AB.(填序号)
A.溶液质量逐渐增大
B.若加入Na2CO3溶液的体积为V,当V<V2时,氯化钠的质量逐渐增大;当V≥V2时,氯化钠的质量不变
C.氯化钙的质量先增大后减小
D.溶液的pH一直在增大.
假设①:石灰水已变质;假设②:制得的气体中无二氧化碳;假设③:制得的气体中有一定量的氯化氢气体.
(1)同学们先探究假设①是否成立.他们将适量的原试剂瓶中的澄清的石灰水倒入小试管中,然后通入二氧化碳气体(填写实验操作),他们根据实验现象确认了石灰水未变质.他们接着探究,通过实验否定了假设②.
(2)同学们继续设计了两个实验来探究假设③,如表所示:
| 实验操作 |  |  |
| 实验现象 | 出现白色沉淀 | ? |
| 实验结论 | 制得的气体中有氯化氢气体 | 制得的气体中有氯化氢气体 |
(3)同学们通过实验确定了澄清石灰水未变浑浊的原因是制得的气体中含有一定量的氯化氢气体.请解释将制得的气体通入澄清石灰水后,石灰水不变浑浊的原因是稀盐酸和氢氧化钙反应生成了氯化钙和水.
| A.对安全的认识 | B.用“化学”眼光分析 |
| ①点燃可燃性气体前一定要验纯 ②煤气泄漏立即打开排气扇 ③煤矿矿井要保持通风、严禁烟火 | ①洗涤剂去除油污是因为乳化作用 ②用适量的熟石灰可中和土壤的酸性 ③用水灭火是降低温度至可燃物的着火点以下 |
| C.化学与健康 | D.对除杂和鉴别的认识 |
| ①霉变的大米洗净烧熟后可以食用 ②利用甲醛水溶液浸泡水产品防腐 ③人体缺铁会导致贫血 | ①用灼热的CuO除去CO中少量CO2 ②用Ca(OH)2溶液除去NaOH溶液中的Na2CO3 ③用燃烧的方法区分羊毛和涤纶 |
| A. | A | B. | B | C. | C | D. | D |
【发现问题】可燃物燃烧的剧烈程度与哪些因素有关呢?
【提出猜想】猜想①:燃烧的剧烈程度可能与氧气浓度有关;
猜想②:燃烧的剧烈程度可能与反应物接触面积有关.
【验证猜想】实验报告如下:
| 验证猜想 | 对比实验操作 | 实验现象 | 实验结论 |
| 猜想① | 将蜡烛分别在空气和纯氧中点燃 | 蜡烛在 氧气中燃烧 比在空气中燃烧更剧烈 | 氧气浓度 越大 燃烧越剧烈 |
| 猜想② | 将质量相同的木炭块 和木炭粉分别放在 氧气中燃烧 | 木炭粉比木炭块 燃烧 更剧烈 | 接触面积 越大 燃烧越剧烈 |
| A. | 糖水 | B. | 牛奶 | C. | 氮气 | D. | 洁净的空气 |
 如图装置,有洗气、储气等用途.在医院给病从输氧气时,也利用了类似的装置,并在装置中盛放大半瓶蒸馏水.以下说法正确的是( )
如图装置,有洗气、储气等用途.在医院给病从输氧气时,也利用了类似的装置,并在装置中盛放大半瓶蒸馏水.以下说法正确的是( )| A. | B导管连接供给氧气的钢瓶 | |
| B. | B导管连接病人吸氧气的塑胶管 | |
| C. | 该装置可用来观察是否已有氧气输出 | |
| D. | 该装置可用来观察输出氧气的速度 |
| A. | 取用大块固体药品--药匙 | B. | 吸取和滴加少量液体--胶头滴管 | ||
| C. | 称量固体药品--托盘天平 | D. | 将少量试剂混合进行反应--试管 |
