题目内容
20.20g10%的稀盐酸和20g10%的氢氧化钠溶液充分反应后,加入石蕊试剂,溶液会变( )| A. | 变红色 | B. | 变蓝色 | C. | 不变色 | D. | 无法判断 |
分析 根据氢氧化钠与盐酸的反应,分析判断出剩余的物质及溶液的酸碱性,再根据紫色石蕊试液在不同酸碱性的溶液中的变色情况分析判断.
解答 解:由NaOH+HCl=NaCl+H2O可知,氢氧化钠与盐酸的溶质的质量比为:40:36.5,溶液中氢氧化钠与盐酸的溶质的质量比为:(20g×10%):(20g×10%)=1:1,所以,反应后稀盐酸有剩余,溶液呈酸性,能使紫色石蕊试液变红色.
故选A.
点评 解答本题的关键是根据氢氧化钠与盐酸的反应,判断出反应剩余的物质,由此就可判断出滴加紫色石蕊试液,石蕊试液的变色.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
11.把一定质量的甲、乙、丙、丁四种物质放入一个密闭容器中,在一定条件下反应一段时间,测得反应后各物质的质量如表,则下列说法中正确的是( )
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前的质量/g | 6.4 | 3.2 | 4.0 | 2.8 |
| 反应后的质量/g | 5.2 | X | 7.2 | 2.8 |
| A. | X=0.4 | |
| B. | 甲和乙是反应物 | |
| C. | 丁一定是单质 | |
| D. | 反应中的甲、丙发生改变的质量比是11:14 |
5.如图是元素周期表的一部分,氢回答相关问题:
(1)氟元素与氯元素位于同一纵行的原因是最外层电子数相同,它们在化学反应中都易得到(选天“得到”或“失去”)电子,与氯元素化学性质相似的元素符号是F.
(2)M2-与Ne核外电子排布相同,则M元素的名称为氧.已知M元素的相对原子质量为a,则M元素原子核内的中子数为a-8.
(3)表中不同种元素最本质的区别是质子数的不同
(4)8号元素与11号元素组成化合物的化学式为:Na2O.
| 第一周期 | 1H | 2He | ||||||
| 第二周期 | 3Li | 4Be | 5B | 6C | 7N | 8O | 9F | 10Ne |
| 第三周期 | 11Na | 12Mg | 13Al | 14Si | 15P | 16S | 17Cl | 18Ar |
(2)M2-与Ne核外电子排布相同,则M元素的名称为氧.已知M元素的相对原子质量为a,则M元素原子核内的中子数为a-8.
(3)表中不同种元素最本质的区别是质子数的不同
(4)8号元素与11号元素组成化合物的化学式为:Na2O.
12.下列有关配制50g5%(1g以下用游码)的氯化钠溶液的实验操作或数据正确的是( )
| A. | 因为食盐是干燥的药品,所以可以直接放在托盘天平的左盘进行称量 | |
| B. | 应用50mL的量筒量取47毫升的蒸馏水 | |
| C. | 量取水时若俯视读数,则所配制氯化钠溶液的溶质质量分数偏大 | |
| D. | 配制50g5%的氯化钠溶液的操作步骤为:称量、量取、溶解、装瓶保存 | |
| E. | 若将上述50g氯化钠溶液稀释成2%的氯化钠溶液,则需要加水75g | |
| F. | 在称量食盐的过程中,发现天平的指针向左偏转,此时应减少药品 | |
| G. | 将称量好的食盐固体直接倒入量筒中进行溶解 | |
| H. | 若是将药品和砝码放反了,其他操作完全正确,则所配制的溶液的溶质质量分数偏小 |
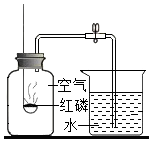 已知空气的主要成份是氮气和氧气.某课外活动小组 设计了测定空气中氧气含量的实验:在燃烧匙内盛过量红磷,点燃后立即插入充满空气的集气瓶中,塞紧橡皮塞,等红磷火焰熄灭,集气瓶冷却至室温后,再打开水夹.实验装置如图:
已知空气的主要成份是氮气和氧气.某课外活动小组 设计了测定空气中氧气含量的实验:在燃烧匙内盛过量红磷,点燃后立即插入充满空气的集气瓶中,塞紧橡皮塞,等红磷火焰熄灭,集气瓶冷却至室温后,再打开水夹.实验装置如图: