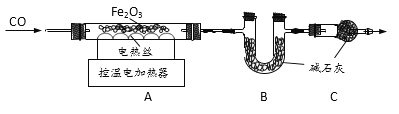
题目内容
【题目】在浓硫酸的催化作用下,固体草酸(H2C2O4)受热分解生成碳的氧化物和水.某化学课外兴趣小组对碳的氧化物的成分进行了实验探究.
(提出问题)如何通过实验确定碳的氧化物的成分.
(猜想)
猜想1 | 猜想2 | 猜想3 |
只有CO | 只有CO2 | ______ |
(设计实验)基于猜想3,兴趣小组同学设计了如图实验装置:
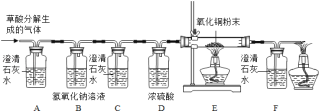
(实验探究)
(1)实验过程中观察到A装置中的澄清石灰水变浑浊,证明草酸分解时有CO2气体产生,A中发生的化学方程式为_______已知:氢氧化钠和氢氧化钙具有相似的化学性质。写出B中发生的化学方程式为______
(2)实验过程中还观察到以下实验现象:①C装置中澄清石灰水不变浑浊;②E装置中_____;③F装置中澄清石灰水变浑浊,证明有CO气体.
(实验结论)通过实验探究证明:猜想3成立.草酸分解的化学方程式是_______.
(问题讨论)
(1)C装置的作用是_______
(2)装置末端酒精灯的作用是尾气处理,写出发生反应的化学方程式_____。
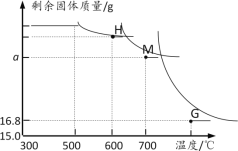
(计算)某研究性学习小组的同学前往当地的石灰石矿区进行调查,他们取了若干块矿石样品,对样品中的碳酸钙的质量分数进行检测,采用了以下的办法:取用8g这种石灰石样品,把40g稀盐酸分四次加入,测量过程所得数据见下表(杂质不溶于水,不与盐酸反应).
序号 | 第一次 | 第二次 | 第三次 | 第四次 |
加入稀盐酸质量g | 10 | 10 | 10 | 10 |
剩余固体质量g | 5.5 | 3.0 | 1.2 | m |
请计算:
(1)哪几次反应中碳酸钙有剩余________;
(2)上表中的m的数值应为________;
(3)这种石灰石中碳酸钙的质量分数为多少?(写出计算过程)______
【答案】CO和CO2 CO2+Ca(OH)2=CaCO3↓+H2O 2NaOH+CO2═Na2CO3+H2O 黑色粉末变成红色 H2C2O4![]() CO↑+CO2↑+H2O 检验二氧化碳是否被除尽 2CO+O2
CO↑+CO2↑+H2O 检验二氧化碳是否被除尽 2CO+O2![]() 2CO2 一、二 1.2 85%
2CO2 一、二 1.2 85%
【解析】
[猜想]碳的氧化物可能是一氧化碳,或二氧化碳,或一氧化碳和二氧化碳;故可根据猜想1、2的内容,推测猜想3的内容;故填:CO和CO2;
[实验探究](1)二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水;氢氧化钠和二氧化碳反应生成碳酸钠和水,故填: CO2+Ca(OH)2=CaCO3↓+H2O;2NaOH+CO2═Na2CO3+H2O;
(2)C装置中澄清石灰水不变浑浊,说明原有的二氧化碳已经被完全吸收;E装置中黑色粉末变成红色,说明氧化铜被还原;F中澄清石灰水变浑浊,说明有二氧化碳生成,说明还原气是CO;故填:黑色粉末变成红色;
[实验结论]
草酸受热分解生成水、一氧化碳和二氧化碳,反应的化学方程式为:H2C2O4![]() CO↑+CO2↑+H2O。故填:H2C2O4
CO↑+CO2↑+H2O。故填:H2C2O4![]() CO↑+CO2↑+H2O;
CO↑+CO2↑+H2O;
[问题讨论]
(1)C装置的作用是检验二氧化碳是否被除尽。故填:检验二氧化碳是否被除尽;
(2)装置末端酒精灯的作用是尾气处理,发生的反应是一氧化碳在空气中燃烧生成二氧化碳,反应的化学方程式为:2CO+O2![]() 2CO2;故填:2CO+O2
2CO2;故填:2CO+O2![]() 2CO2;
2CO2;
[计算]
(1)每次加入的盐酸质量是相等的,但是第一、二次减少2.5g,第三次减少1.8g,所以第一次、第二次反应后碳酸钙质量有剩余;
(2)每次加入的盐酸质量是相等的,但是第一、二次减少2.5g,第三次只减少1.8g,说明碳酸钙完全反应,只剩余不和稀盐酸发生反应的杂质,所以第四次反应后剩余固体质量也是1.2g;
(3)通过第三次和的四次的数据可知:样品中杂质的质量为1.2g,所以石灰石中碳酸钙的质量分数为:![]() ×100%=85%.
×100%=85%.
故填:(1)一、二;(2)1.2;(3)85%.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案