题目内容
6.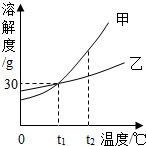 如图是甲、乙两种固体物质(均不含结晶水)的溶解度曲线,请据图回答问题:
如图是甲、乙两种固体物质(均不含结晶水)的溶解度曲线,请据图回答问题:(1)当温度为t1时,甲、乙两种物质的溶解度相等;
(2)0℃时,在100g水中加入30g甲物质,所得溶液为饱和溶液(选填“饱和溶液”或“不饱和溶液);
(3)将t2℃等质量的甲、乙两种物质配制成饱和溶液,所需水的质量甲<乙(填“>”“=”或“<”);
(4)若将t2℃甲、乙两种物质的饱和溶液各100g,温度降低到t1℃,则下列各关系量的比较中正确的是D(选序号).
A、析出晶体质量:甲=乙 B、剩余溶液中溶剂质量:甲>乙
C、剩余溶液中溶质质量:甲<乙 D、剩余溶液中溶质质量分数:甲=乙.
分析 (1)溶解度曲线的交点表示该温度下两物质的溶解度相等;
(2)据该温度下甲的溶解度分析是否全部溶解;
(3)据该温度下甲乙的溶解度大小解答;
(4)等质量的饱和溶液降低相同的温度,溶解度变化大的析出晶体多,并结合(3)及降温后二者的溶解度相等、饱和溶液中溶质的质量分数=$\frac{溶解度}{溶解度+100g}$×100%分析解答.
解答 解:(1)t1℃时两物质的溶解度曲线交于一点,表示该温度下甲乙的溶解度相等;
(2)0℃时甲的溶解度是30g,即100g水中最多溶解30g的甲,所以在100g水中加入30g甲物质,所得溶液为饱和溶液;
(3)t2℃时甲的溶解度大于乙的溶解度,即等质量的水中最多溶解的物质的质量甲>乙,所以等质量的甲乙两种物质的饱和溶液中溶剂的质量关系为甲<乙;
(4)A、等质量的甲乙饱和溶液降低相同的温度,甲的溶解度变化比乙大,甲析出晶体多,故错误;
B、降温溶液中溶剂的质量不变,所以溶液中溶剂的质量依然是甲<乙,故错误;
C、t1℃时甲乙的溶解度相等,所以剩余溶液中溶质的质量相等,故错误;
D、由饱和溶液中溶质的质量分数计算方法可知:溶解度相等则溶质的质量分数相等,所以降温后两溶液的溶质质量分数相等,正确;
故答案为:(1)t1;(2)饱和溶液;(3)<;(4)D.
点评 本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力.

练习册系列答案
相关题目
8.水是我们日常生活必不可少的物质,下列有关水的说法正确的是( )
| A. | 用过滤的方法可以使硬水软化 | |
| B. | 用活性炭吸附水中的色素和异味是化学变化 | |
| C. | 水通电分解产生氢气和氧气质量比为2:1 | |
| D. | 水发生三态变化时,发生的是物理变化 |
11.多种角度认识物质,能帮助我们更全面了解物质世界.请回答下列问题:
(1)认识物质的组成和结构
请用化学用语填写如表:
(2)认识物质的类别
①通常人们根据物质的组成和结构对物质进行分类.不同种类的物质具有不同的性质,这是因为构成物质的微粒不同.
②对于乙醇(化学式为C2H5OH)的类别,小明观察乙醇的组成后,认为它应属于碱,其理由是乙醇中含有氢、氧元素;小亮进行某实验后,认为它不属于碱,其理由是在水溶液中不会电离出氢氧根离子;小华认为它正确的类别应为醇,其理由是符合醇的一般形式,具有醇的性质;
(3)认识物质的性质
①用pH试纸测定盐酸、石灰水、食盐水的pH,可以得出三者的性质依次是酸性、碱性、中性;
②盐酸是一种典型的酸,它可以与铁锈作用,其反应的化学方程式为6HCl+Fe2O3=2FeCl3+3H2O;
③石灰水在空气中敞口久置会变浑浊,发生反应的化学方程式为CO2+Ca(OH)2=CaCO3↓+H2O;
④在食盐水中滴加硝酸银溶液出现白色沉淀,其反应的化学方程式为NaCl+AgNO3=NaNO3+AgCl↓.
(4)认识物质的制法
工业上用电解饱和食盐水方法,制得氢氧化钠、氢气和氯气,氢气在氯气中燃烧得到氯化氢,氯化氢溶于水制的盐酸.
①写出上述两个反应的化学方程式2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl;
②在实验室中判断一杯食盐水是否达到饱和的方法是加入食盐,观察固体是否继续溶解;
③由氢气可以在氯气中燃烧这一变化可以得到的一条启示是燃烧不一定需要氧气.
(1)认识物质的组成和结构
请用化学用语填写如表:
| 物质 | 氯化氢 | 盐酸 | 氢氧化钙 | 石灰水 | 氯化钠 | 食盐水 |
| 组成元素 | H、Cl | H、Cl、O | Ca、H、O | Ca、H、O | Na、Cl | Na、Cl、H、O |
| 构成粒子 | HCl | HCl、H2O | Ca2+、OH- | Ca2+、OH-、H2O | Na+、Cl- | Na+、Cl-、H2O |
①通常人们根据物质的组成和结构对物质进行分类.不同种类的物质具有不同的性质,这是因为构成物质的微粒不同.
②对于乙醇(化学式为C2H5OH)的类别,小明观察乙醇的组成后,认为它应属于碱,其理由是乙醇中含有氢、氧元素;小亮进行某实验后,认为它不属于碱,其理由是在水溶液中不会电离出氢氧根离子;小华认为它正确的类别应为醇,其理由是符合醇的一般形式,具有醇的性质;
(3)认识物质的性质
①用pH试纸测定盐酸、石灰水、食盐水的pH,可以得出三者的性质依次是酸性、碱性、中性;
②盐酸是一种典型的酸,它可以与铁锈作用,其反应的化学方程式为6HCl+Fe2O3=2FeCl3+3H2O;
③石灰水在空气中敞口久置会变浑浊,发生反应的化学方程式为CO2+Ca(OH)2=CaCO3↓+H2O;
④在食盐水中滴加硝酸银溶液出现白色沉淀,其反应的化学方程式为NaCl+AgNO3=NaNO3+AgCl↓.
(4)认识物质的制法
工业上用电解饱和食盐水方法,制得氢氧化钠、氢气和氯气,氢气在氯气中燃烧得到氯化氢,氯化氢溶于水制的盐酸.
①写出上述两个反应的化学方程式2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl;
②在实验室中判断一杯食盐水是否达到饱和的方法是加入食盐,观察固体是否继续溶解;
③由氢气可以在氯气中燃烧这一变化可以得到的一条启示是燃烧不一定需要氧气.
18. 取14.6g变质的氢氧化钠固体样品(不含水)于锥形瓶中,加入50.0g水,充分溶解,再向锥形瓶中滴加的溶质质量分数为7.3%的稀盐酸.实验测得加入稀盐酸的质量与锥形瓶中物质的总质量关系如图所示.(资料酸钠与稀盐酸反应分两步进行:Na2CO3+HCl═NaHCO3+NaCl,NaHCO3+HCl═NaCl+H2O+CO2↑)下列说法正确的是( )
取14.6g变质的氢氧化钠固体样品(不含水)于锥形瓶中,加入50.0g水,充分溶解,再向锥形瓶中滴加的溶质质量分数为7.3%的稀盐酸.实验测得加入稀盐酸的质量与锥形瓶中物质的总质量关系如图所示.(资料酸钠与稀盐酸反应分两步进行:Na2CO3+HCl═NaHCO3+NaCl,NaHCO3+HCl═NaCl+H2O+CO2↑)下列说法正确的是( )
 取14.6g变质的氢氧化钠固体样品(不含水)于锥形瓶中,加入50.0g水,充分溶解,再向锥形瓶中滴加的溶质质量分数为7.3%的稀盐酸.实验测得加入稀盐酸的质量与锥形瓶中物质的总质量关系如图所示.(资料酸钠与稀盐酸反应分两步进行:Na2CO3+HCl═NaHCO3+NaCl,NaHCO3+HCl═NaCl+H2O+CO2↑)下列说法正确的是( )
取14.6g变质的氢氧化钠固体样品(不含水)于锥形瓶中,加入50.0g水,充分溶解,再向锥形瓶中滴加的溶质质量分数为7.3%的稀盐酸.实验测得加入稀盐酸的质量与锥形瓶中物质的总质量关系如图所示.(资料酸钠与稀盐酸反应分两步进行:Na2CO3+HCl═NaHCO3+NaCl,NaHCO3+HCl═NaCl+H2O+CO2↑)下列说法正确的是( )| A. | N点的溶液表示氢氧化钠被恰好完全反应 | |
| B. | PQ段(不含P点)溶液的pH<7 | |
| C. | NP段表示产生气体的过程,a的值为210.2 | |
| D. | 该固体样品中氢氧化钠的质量为8.0g |

 为解决过度使用化石燃料造成的能源危机及环境问题,科学家提出如图的科学构想:
为解决过度使用化石燃料造成的能源危机及环境问题,科学家提出如图的科学构想: