题目内容
12.(1)某氧化物化学式为NxOY.其中氮元素和氧元素的质量比为7:4,此氧化物化学中X与Y的比为2:1,此化学式是N2O.(2)一种铁的氧化物中,铁元素与氧元素的质量比是7:3,则此氧化物的化学式为Fe2O3.
(3)X、Y两元素的相对原子质量比是7:2,在它们组成的化合物中,X与Y元素的质量比为7:3,试写出此化合物的化学式X2Y3.
分析 (1)根据题意,有一种氮的氧化物,其中氮元素与氧元素质量比为7:4,结合化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.
(2)设铁的氧化物中Fe、O的原子个数为a、b,然后利用元素的质量比为7:3来计算,求出a与b的比,得到化学式.
(3)要确定这种化合物的化学式,必须确定元素X、Y在化合物中原子个数关系,可通过假设原子个数的方法,利用所给的数据计算出两元素的原子个数比,最后完成化学式的推断.
解答 解:(1)由氧化物中氮元素和氧元素的质量比为7:4,则氮、氧元素组成的氧化物中两种元素的原子个数比=$\frac{7}{14}$:$\frac{4}{16}$=2:1,因此该氧化物的化学式可表示为N2O.
故答案为:2:1;N2O;
(2)设铁的氧化物中Fe、O的原子个数为a、b,
则由Fe、O元素的质量比为7:3,得:
$\frac{56a}{16b}=\frac{7}{3}$
$\frac{a}{b}$=$\frac{2}{3}$
故填:Fe2O3;
(3)设化合物的化学式为XcYd,则元素X的相对原子质量为7M时,元素Y的相对原子质量为2M;
化合物XcYd中X、Y两元素的质量比=(7M×c):(2M×d)=7c:2d,根据题意:化合物中X、Y两元素的质量比为7:3,则
7c:2d=7:3 解得c:d=2:3,则这种化合物的化学式为X2Y3;
故填:X2Y3.
点评 本题考查学生利用化合物中元素的质量比、相对原子质量之比进行推断化学式,考查同学们分析问题、灵活应用所学知识解题的能力.

练习册系列答案
相关题目
3.如图实验操作中,正确的是( )
| A. |  熄灭酒精灯 | B. |  取用液体 | C. |  过滤 | D. |  取用固体 |
1.下列保护自然资源的认识中,错误的是( )
| A. | 寻找金属替代品有利于保护金属资源 | |
| B. | 植树造林有利于保护空气资源 | |
| C. | 禁止废水任意排放有利于保护水资源 | |
| D. | 用乙醇汽油代替汽油能抑制温室效应 |
5.下列说法中,正确的是( )
| A. | 用10mL量筒量取5.26mL蒸馏水 | |
| B. | 用托盘天平称取11.7gCuO粉末 | |
| C. | 用50mL烧杯量取20mL水 | |
| D. | 用广泛pH试纸测得硫酸溶液的pH为3.5 |

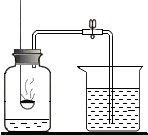 用燃烧红磷(红磷过量)的方法测定空气中氧气的含量,如图所示,当火焰熄灭后,打开弹簧夹,烧杯中的水流入集气瓶中,约占总体积的$\frac{1}{5}$,剩余气体主要是氮气.根据观察的现象推测,氮气具有哪些性质?
用燃烧红磷(红磷过量)的方法测定空气中氧气的含量,如图所示,当火焰熄灭后,打开弹簧夹,烧杯中的水流入集气瓶中,约占总体积的$\frac{1}{5}$,剩余气体主要是氮气.根据观察的现象推测,氮气具有哪些性质?