题目内容
20.国家规定工业废水排放的pH范围:6<pH<9,某工厂废水的pH为10.5,要使其pH达到允许排放的范围,下列措施不可行的是( )| A. | 加入适量的石灰石粉末 | B. | 加入适量的稀硫酸 | ||
| C. | 通入适量的二氧化碳气体 | D. | 加入适量的酸性废水 |
分析 根据酸碱中和的知识进行分析,废水的pH为10.5,呈碱性,排放标准为6<pH<9,可以加入显酸性的物质.
解答 解:A、碳酸钙不与碱性物质反应,故A错误,选;
B、加入适量的稀硫酸能与废水中的碱性物质反应,故B方法正确,不选;
C、通入适量的二氧化碳能与废水中的碱性物质反应,故C方法正确,不选;
D、加入适量的酸性废水能与废液中的碱性物质反应,故D方法正确,不选;
故选A.
点评 本题考查了废水的处理方法,完成此题,可以依据已有的知识进行.

练习册系列答案
相关题目
10. 如图是某化学反应的微观模型,“○”、“●”分别表示不同元素的原子,下列各项中对图示模型理解正确的是( )
如图是某化学反应的微观模型,“○”、“●”分别表示不同元素的原子,下列各项中对图示模型理解正确的是( )
 如图是某化学反应的微观模型,“○”、“●”分别表示不同元素的原子,下列各项中对图示模型理解正确的是( )
如图是某化学反应的微观模型,“○”、“●”分别表示不同元素的原子,下列各项中对图示模型理解正确的是( )| A. | 该反应属于分解反应 | |
| B. | 反应物和生成物中只有一种单质 | |
| C. | 反应中原子的个数没有变 | |
| D. | 参加反应的两种分子个数之比为3:2 |
11.已知钠、钾等金属在常温下可与水发生剧烈反应,如金属钠与水反应的化学方程式为2Na+2H2O═2NaOH+H2↑,据此判断下列说法中错误的是( )
| A. | 钠不能保存在水中 | |
| B. | 将石蕊试液滴入钠与水反应后的溶液中会变为蓝色 | |
| C. | 不能用手直接拿金属钠 | |
| D. | 将钠投入硫酸铜溶液中会析出红色物质 |
8.有两瓶体积相同的溶液,一瓶为浓硫酸,另一瓶为稀硫酸,下列方法,不能用来区别它们的是( )
| A. | 看外观 | |
| B. | 分别加入到少量水中,观察温度的变化 | |
| C. | 分别称量 | |
| D. | 分别用小木条蘸取少量,观察木条是否变黑 |
15.下列化肥中,与熟石灰混合研磨有刺激性气味气体生成的是( )
| A. | 尿素 | B. | 碳酸氢铵 | C. | 氯化钾 | D. | 硫酸钾 |
5.关于生活中常见的盐,下列说法中错误的是( )
| A. | 碳酸钙可用作补钙剂 | |
| B. | 食盐可用于调味和腌渍蔬菜、鱼、肉、蛋等 | |
| C. | 纯碱在农业上常用于改良酸性土壤 | |
| D. | 小苏打是焙制糕点所用的发酵粉的主要成分之一 |
9.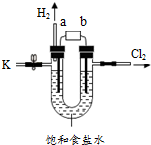 某学习小组在老师的指导下,用自制的实验装置(如图所示)进行电解饱和食盐水的实验.
某学习小组在老师的指导下,用自制的实验装置(如图所示)进行电解饱和食盐水的实验.
资料:
1:电解饱和食盐水的化学方程式:
2NaCl+2H2O $\frac{\underline{\;通电\;}}{\;}$ 2NaOH+H2↑+Cl2↑
2:Cl2能溶于水.
探究活动一:确定电解饱和食盐水后的产物
(1)此电解原理与电解水原理类似,则a端为电源的负
极,甲组同学为了收集另一电极产生的气体,
他们用向上排空气法 法进行收集;
(2)甲组同学从K处取出一部分待测液,往里面加入
酚酞,发现溶液变红,说明电解后生成了氢氧化钠;
探究活动二:测定待测液中氢氧化钠的质量分数
【实验1】用酸碱中和法测定
甲组同学称取10g待测液于烧杯中,加水稀释,用带有刻度的滴管逐滴加入溶质质量分数为19.6%的稀硫酸,边加边振荡,用pH计测定溶液的pH,所得数据如下:
(3)写出氢氧化钠与稀硫酸反应的化学方程式:2NaOH+H2SO4=Na2SO4+2H2O;
(4)当加入6g稀硫酸时,溶液中溶质为氢氧化钠、硫酸钠,利用氢氧化钠与稀硫酸恰好完全反应时的实验数据,计算待测液中氢氧化钠的质量分数为16%;
【实验2】用沉淀法测定
资料摘要:氢氧化钠与氯化镁溶液发生反应:2NaOH+MgCl2=Mg(OH)2↓+2NaCl
乙组同学按下图所示的实验步骤进行实验:

(5)步骤 ②加入的氯化镁溶液必须足量,其目的是使氢氧化钠完全反应;滴加一定量氯化镁溶液后,判断所加氯化镁溶液是否足量的具体操作:静置,取少量反应后的待测溶液,滴加氢氧化钠;产生白色沉淀,氯化镁已经过量(写出实验步骤、现象和结论);
(6)步骤 ③过滤出的沉淀物是氢氧化镁(填物质的名称);
(7)利用沉淀物的质量计算氢氧化钠的质量分数,若缺少步骤④的操作,所
测定氢氧化钠的质量分数将偏大(选填“偏大”、“偏小”或“没影响”).
 某学习小组在老师的指导下,用自制的实验装置(如图所示)进行电解饱和食盐水的实验.
某学习小组在老师的指导下,用自制的实验装置(如图所示)进行电解饱和食盐水的实验.资料:
1:电解饱和食盐水的化学方程式:
2NaCl+2H2O $\frac{\underline{\;通电\;}}{\;}$ 2NaOH+H2↑+Cl2↑
2:Cl2能溶于水.
探究活动一:确定电解饱和食盐水后的产物
(1)此电解原理与电解水原理类似,则a端为电源的负
极,甲组同学为了收集另一电极产生的气体,
他们用向上排空气法 法进行收集;
(2)甲组同学从K处取出一部分待测液,往里面加入
酚酞,发现溶液变红,说明电解后生成了氢氧化钠;
探究活动二:测定待测液中氢氧化钠的质量分数
【实验1】用酸碱中和法测定
甲组同学称取10g待测液于烧杯中,加水稀释,用带有刻度的滴管逐滴加入溶质质量分数为19.6%的稀硫酸,边加边振荡,用pH计测定溶液的pH,所得数据如下:
| 加入稀硫酸的质量/g | 0 | 4.0 | 6.0 | 8.0 | 10.0 | 12.0 |
| 烧杯中溶液的pH | 13.0 | 12.8 | 12.5 | 12.3 | 7.0 | 1.3 |
(4)当加入6g稀硫酸时,溶液中溶质为氢氧化钠、硫酸钠,利用氢氧化钠与稀硫酸恰好完全反应时的实验数据,计算待测液中氢氧化钠的质量分数为16%;
【实验2】用沉淀法测定
资料摘要:氢氧化钠与氯化镁溶液发生反应:2NaOH+MgCl2=Mg(OH)2↓+2NaCl
乙组同学按下图所示的实验步骤进行实验:

(5)步骤 ②加入的氯化镁溶液必须足量,其目的是使氢氧化钠完全反应;滴加一定量氯化镁溶液后,判断所加氯化镁溶液是否足量的具体操作:静置,取少量反应后的待测溶液,滴加氢氧化钠;产生白色沉淀,氯化镁已经过量(写出实验步骤、现象和结论);
(6)步骤 ③过滤出的沉淀物是氢氧化镁(填物质的名称);
(7)利用沉淀物的质量计算氢氧化钠的质量分数,若缺少步骤④的操作,所
测定氢氧化钠的质量分数将偏大(选填“偏大”、“偏小”或“没影响”).
10.下列说法中正确的是( )
| A. | 具有相同质子数的微粒一定属于同一种元素 | |
| B. | 由不同种元素组成的物质一定是化合物 | |
| C. | 盐的组成元素中一定不含氢元素 | |
| D. | 不饱和溶液变成饱和溶液后溶质的质量分数可能不变 |
