题目内容
2.海洋是个“聚宝盆”其中蕴含大量的镁元素,从海水中提取金属镁的过程如图1所示:
(1)在上述转化过程中发生中和反应的是②(填反应顺序号).海水中本身就含有氯化镁,则①、②两步的作用是将氯化镁富集起来.
(2)我国化学家侯德榜在氨碱法的基础上创立的“侯氏制碱法“,是向滤出NaHCO3晶体后的NH4Cl溶液中加入NaCl粉末,析出可用作肥料的NH4Cl.NH4Cl和NaCl两种物质的溶解度曲线如图2所示.
①写出一条P点表示的意义t2℃时,NH4Cl和NaCl的溶解度相等.
②若把t1℃时NH4Cl和NaCl的饱和溶液,均升温到t3℃,
则t3℃时NH4Cl溶液的溶质质量分数小于NaCl溶液
的溶质质量分数(填“大于”、“小于”、“等于”之一).
③t1℃时,一小试管内盛有NH4Cl的饱和溶液,试管底部还存有少许NH4Cl固体,将小试管放入盛有水的烧杯中,现将多量的NaOH固体加入烧杯内的水中,小试管内的固体物质逐渐溶解,原因是氢氧化钠溶于水放出热量,温度升高,NH4Cl的溶解度增大,变为不饱和溶液,所以又能溶解氯化铵了.
分析 (1)中和反应是酸与碱起反应生成盐和水的反应,海水中的氯化镁浓度较低,结合提取镁的过程进行分析解答有关的问题;
(2)如图2是氯化铵和氯化钠两种固体物质的溶解度曲线,根据固体溶解度曲线的意义及温度对固体溶解度的影响,进行分析处理题目
解答 解:(1)由提取镁的过程可知,反应②中氢氧化镁和稀盐酸反应生成氯化镁和水,属于酸与碱发生了反应生成了盐和水,属于中和反应;海水中含有的氯化镁浓度较低,加入石灰乳变为氢氧化镁沉淀,过滤后加入盐酸制备氯化镁,再经过蒸发干燥制备无水氯化镁,最后经过通电可制得镁;通过前两步反应我们将氯化镁富集起来;
(2)①通过分析溶解度曲线可知,P点的含义是:t2℃时,NH4Cl和NaCl的溶解度曲线交于一点,此时量物质的溶解度相等;
②t1℃时NaCl的溶解度大于NH4Cl的溶解度,故t1℃时NH4Cl和NaCl的饱和溶液的溶质质量分数相等,若把t1℃时NH4Cl和NaCl的饱和溶液,均升温到t3℃,由于两种物质的溶解度都随温度的升高而增大,故两种物质的溶质质量分数均与t1℃时的溶质质量分数相同,故NH4Cl溶液的溶质质量分数小于NaCl溶液的溶质质量分数;
③t1℃时,一小试管内盛有NH4Cl的饱和溶液,试管底部还存有少许NH4Cl固体,将小试管放入盛有水的烧杯中,现将多量的NaOH固体加入烧杯内的水中,小试管内的固体物质逐渐溶解,原因是氢氧化钠溶于水放出热量,温度升高,NH4Cl的溶解度增大,变为不饱和溶液,所以又能溶解氯化铵了.
故答案为:(1)②、将氯化镁富集起来;
(2)①t2℃时,NH4Cl和NaCl的溶解度相等(其他合理答案也可);
②小于; ③氢氧化钠溶于水放出热量,温度升高,NH4Cl的溶解度增大,变为不饱和溶液,所以又能溶解氯化铵了.
点评 本题考查的是溶解度曲线的应用,完成此题,可以依据已有的溶解度曲线的意义进行.

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案| A. | 混合物、金属氧化物、盐、 | B. | 单质、氧化物、混合物 | ||
| C. | 纯净物、混合物、盐 | D. | 单质、非金属氧化物、盐 |

关于该实验有以下说法:
①a是分液漏斗 ②酒精灯加上铁丝网罩的作用是集中火焰、提高温度 ③若D中石蕊溶液始终没有变红,则C装置中M可能是氢氧化钠溶液 ④尾气的处理方法是在D装置右端的导管口放一盏酒精灯 ⑤A中的稀盐酸可以用稀硫酸代替
以上说法中错误的是( )
| A. | ①②⑤ | B. | ①④⑤ | C. | ②③⑤ | D. | ①③④ |
| A. | 一瓶浓硫酸溶液的pH=a,将其敞口放置一段时间后溶液的pH=b | |
| B. | 欲用量筒量取amL溶液,俯视刻度线读出读数bmL | |
| C. | 试管内稀盐酸质量为a,加入铜粉一段时间后溶液质量为b | |
| D. | 酒精和水混合前的体积之和为a,混合后总体积为b |
| X | Y | Z | |
| ① | CO2 | Ca(OH)2溶液 | H2O |
| ② | H2 | Cl2 | CuO |
| ③ | Ba(NO3)2溶液 | 稀硫酸 | Na2CO3溶液 |
| ④ | Fe2O3 | CO | 稀盐酸 |
| A. | ①② | B. | ①②③④ | C. | ①③④ | D. | ①③ |
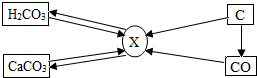 碳和碳的化合物间的部分转化关系如图所示.则下列说法正确的是( )
碳和碳的化合物间的部分转化关系如图所示.则下列说法正确的是( )| A. | 由碳酸转化成X一定要在加热条件下进行 | |
| B. | 由碳转化为X一定发生的是化合反应 | |
| C. | 物质X一定是二氧化碳 | |
| D. | 若使一氧化碳转化成X,只能通过一氧化碳在空气(或氧气)中燃烧获得 |

