题目内容
(8分)有铁粉和铜粉的均匀混合物,甲、乙、丙三位同学分别取该混合物与稀硫酸反应,所得数据如下表所示:
|
|
甲 |
乙 |
丙 |
|
取用金属混合物的质量/g |
10 |
10 |
20 |
|
取用稀硫酸的质量/g |
100 |
120 |
100 |
|
反应后过滤,得干燥固体的质量/g |
4 |
4 |
13 |
请分析数据,回答下列问题:
(1)甲所得溶液中含有溶质的是 。
(2)根据实验数据分析,若取用金属混合物15g,加入到120g稀硫酸中,充分反应后最终得到固体质量为 。
(3)计算丙同学所得溶液中溶质的质量分数。(写出计算过程,计算结果精确到0.1%)
(1) H2SO4 、FeSO4 (各1分,共2分)
(2) 6.6g (2分)
(3) 17.8%
【解析】(1)由金属活动性可知铁与酸反应,而铜不可与酸反应,Fe+H2SO4=FeSO4+H2↑,又由丙同学实验数据可分析出甲同学实验过程中稀硫酸有剩余,故溶液溶质为H2SO4 、FeSO4
(2)由甲、丙同学实验数数据可知,100g稀硫酸可以与7gFe反应,故120g稀硫酸可以与8.4gFe反应,15g该金属混合物含Fe质量为15g×(10g-4g)/10g=9g,故金属混合物15g加入到120g稀硫酸中,充分反应后最终得到固体质量为15g-8.4g=6.6g
(3)解:由甲、乙两同学实验数据对比知,:10g金属混合物中铁已完全反应,剩余4g固体为铜,由此推知20g金属混合物中含铜8g。由于丙同学实验剩余的13g固体中含铁5g,故丙同学实验中硫酸已完全反应,且参加反应的铁为7g。
设生成硫酸亚铁的质量为x,生成氢气的质量为y
Fe + H2SO4 = FeSO4 + H2↑
56 152 2
7g x y
得方程 56 :152 = 7g :x
56 :2 = 7g :y
解得 x = 19g y = 0.25 g
∴反应后溶液质量为:20g -13g + 100g -0.25g = 106.75 g
反应后溶液中硫酸亚铁的质量分数为:
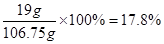
答:丙同学所得溶液中硫酸亚铁的质量分数为17.8%

有铁粉和铜粉的均匀混合物,甲、乙、丙三位同学分别取该混合物与稀硫酸反应,所得数据如下表所示:
| 甲 | 乙 | 丙 | |
| 取用金属混合物的质量/g | 10 | 10 | 20 |
| 取用稀硫酸的质量/g | 100 | 120 | 100 |
| 反应后过滤,得干燥固体的质量/g | 4 | 4 | 13 |
请分析数据,回答下列问题:
(1)甲所得溶液中含有溶质的是 。
(2)根据实验数据分析,若取用金属混合物15g,加入到120g稀硫酸中,充分反应后最终得到固体质量为 。
(3)计算丙同学所得溶液中溶质的质量分数。(写出计算过程,计算结果精确到0.1%)