题目内容
9.化工生产中需要对原料提纯,以利于提高产品质量.经测定某氯化钠样品中混有硫酸钠,为了除杂质并制得纯净的氯化钠固体,在实验室研究中某学生设计方案如下: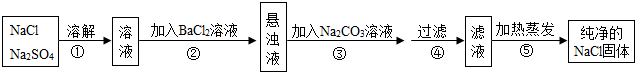
回答下列问题.
(1)操作②能否用硝酸钡溶液?说明理由不能用硝酸钡溶液,会引入新的硝酸钠杂质无法出去;
(2)进行操作②后,如何判断硫酸钠已除尽,方法是向上层清液中滴加氯化钡溶液,看是否有沉淀生成;②中会有一种白色沉淀生成,该沉淀能不能溶于硝酸?不能
(3)操作③的目的是使钡离子完全沉淀,写出③中发生的化学反应方程式:Na2CO3+BaCl2=BaCO3↓+2NaCl;
(4)此设计方案是否严密,说明理由不严密,过量的碳酸钠没有除去.
分析 (1)根据硝酸钡溶液和硫酸钠反应生成硫酸钡沉淀和硝酸钠,硝酸钠属于新的杂质进行分析;
(2)根据氯化钡和硫酸溶液反应会生成硫酸钡沉淀和氯化钠,硫酸钡沉淀难溶于硝酸进行分析;
(3)根据碳酸钠和氯化钡反应生成碳酸钡沉淀和氯化钠进行分析;
(4)根据最后过量的碳酸钠没有除去进行分析.
解答 解:(1)硝酸钡溶液和硫酸钠反应生成硫酸钡沉淀和硝酸钠,硝酸钠属于新的杂质,所以不能用硝酸钡溶液;
(2)氯化钡和硫酸溶液反应会生成硫酸钡沉淀和氯化钠,所以判断硫酸钠已除尽,方法是:向上层清液中滴加氯化钡溶液,看是否有沉淀生成,该沉淀不溶于硝酸;
(3)碳酸钠和氯化钡反应生成碳酸钡沉淀和氯化钠,所以操作③的目的是使钡离子完全沉淀,化学方程式为:Na2CO3+BaCl2=BaCO3↓+2NaCl;
(4)最后过量的碳酸钠没有除去,所以此设计方案不严密.
故答案为:(1)不能用硝酸钡溶液,会引入新的硝酸钠杂质无法出去;
(2)向上层清液中滴加氯化钡溶液,看是否有沉淀生成,不能;
(3)使钡离子完全沉淀,Na2CO3+BaCl2=BaCO3↓+2NaCl;
(4)不严密,过量的碳酸钠没有除去.
点评 本题主要考查了物质的分离操作和除去杂质的方法,要根据物质的性质选择适当的方法或试剂进行解答,本题难度较大,培养学生对知识的应用和理解的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.有氧化铁和另一种金属氧化物组成的混合物中,氧元素的质量分数为35%,则另一种氧化物可能是( )
| A. | CuO | B. | MgO | C. | CaO | D. | HgO |
17.氯化钠在水中发生电离的原因是( )
| A. | 电流的作用 | B. | 搅拌的作用 | ||
| C. | 水分子的作用 | D. | 溶液中自由电子的作用 |
 溶液在生产和科研中具有广泛的用途,与人们的生活密不可分.
溶液在生产和科研中具有广泛的用途,与人们的生活密不可分.
