题目内容
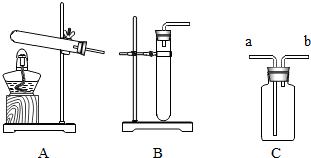
20.根据下列实验装置图,回答有关问题.
(1)图中标有①的仪器名称是铁架台.
(2)实验室用氯酸钾和二氧化锰制氧气,反应的化学方程式为2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,若要获得较纯净氧气,应选择的装置组合是BE.
(3)实验室用A装置制备氢气,且产生的气体中不含酸性杂质气体,则试剂X常用稀硫酸,用F装置收集氢气,导管口a应与c(选填“b”或“c”)相连.
(4)兴趣小组的同学设计了如图1、图2所示装置进行实验来探究浓硫酸能否与Cu反应.结果实验现象相同--加热后铜片上有气泡,溶液逐渐变成了蓝色,石蕊试液变红,说明浓硫酸能与Cu反应.

请回答:①同学们猜想生成的气体可能是SO2、O2、H2中的一种或几种.你认为他们猜想的依据是质量守恒定律(或化学反应前后元素的种类不变).
②石蕊试液变红说明生成的气体中有SO2(或二氧化硫),后经验证没有另两种气体生成.
③在图1装置中,“蘸有浓碱液的棉花”的作用是吸收多余的二氧化硫,防止污染空气.
④比较两实验装置,图2装置的优点是能控制反应的发生与停止、能防止倒吸
⑤请根据以上信息写出浓硫酸与Cu反应的化学反应方程式Cu+2H2SO4=CuSO4+SO2↑+2H2O.
分析 (1)根据实验室常用仪器分析回答;
(2)根据氯酸钾在二氧化锰的催化作用下加热生成氯化钾和氧气,该反应的反应物是固体,反应条件是加热,排水法收集的氧气纯净,排空气法收集的氧气干燥,进行分析;
(3)根据盐酸有挥发性,氢气密度比空气小进行分析;
(4)①根据质量守恒定律化学反应前后元素的种类不变猜想生成的气体;
②结合猜想中的气体,对实验中现象进行分析,对气体组成做出判断;
③观察装置中蘸有浓碱液的棉花的放置位置,利用碱液的性质,对其作用进行推断;
④根据装置特点分析其优越性;
⑤根据现象推导生成物质,据反应物、生成物书写化学方程式.
解答 解:(1)通过分析题中所指仪器的作用可知,①是铁架台;
(2)氯酸钾在二氧化锰的催化作用下加热生成氯化钾和氧气,化学方程式为:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,该反应的反应物是固体,反应条件是加热,所以应选择的发生装置是B,排水法收集的氧气纯净,排空气法收集的氧气干燥,氧气不易溶于水,所以应选择的收集装置是E;
(3)盐酸有挥发性,金属和酸反应放热,温度升高会挥发出部分氯化氢气体,所以实验室用A装置制备氢气,且产生的气体中不含酸性杂质气体,则试剂X常用稀硫酸,用F装置收集氢气,氢气密度比空气小,故导管口a应与c相连,从短管进气,将空气挤压到 集气瓶底部排出;
(4)①根据质量守恒定律化学反应前后元素的种类不变,猜想生成的气体可能是SO2、O2、H2中的一种或几种;
②石蕊遇酸变红,观察到石蕊变红,说明气体遇水可形成酸性溶液,三种气体中只有二氧化硫溶于水溶液显酸性,因此,判断气体中含有二氧化硫;
③二氧化硫能与碱溶液发生反应,所以放置于管口蘸有浓碱液的棉花是为了吸收二氧化硫,防止造成空气污染;
④比较两实验装置,图2装置可通过抽动铜丝控制反应的发生和停止,反应结束后可将AB连接的胶皮管分离,防止液体倒吸;
⑤由现象可知:加热后溶液逐渐变成了蓝色,说明反应生成了硫酸铜溶液,且由实验探究可知生成了二氧化硫气体,据反应前后元素种类不变可知反应还生成水,反应的化学反应方程式为Cu+2H2SO4=CuSO4+SO2↑+2H2O;
故答案为:(1)铁架台;
(2)2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;BE;
(3)稀硫酸;c;
(4)①质量守恒定律(或化学反应前后元素的种类不变);
②SO2(或二氧化硫);
③吸收多余的二氧化硫,防止污染空气;
④能控制反应的发生与停止、能防止倒吸;
⑤Cu+2H2SO4=CuSO4+SO2↑+2H2O.
点评 本题既涉及气体的装置选取、反应原理、常用仪器,又涉及从信息中获取新知识并运用该知识分析问题,思维难度较大,综合性较强,处理时应注意知识的迁移与类比,结合题意细心分析解答.

| A. | 空气是一种宝贵的自然资源 | |
| B. | 空气是几种气体组成的混合物 | |
| C. | 水循环的环节只有降水和蒸发 | |
| D. | 生活中一水多用是节约用水的好习惯 |
| A. | 甲烷、食盐、生铁 | B. | 氢气、硫酸钠、冰水混合体 | ||
| C. | 液氧、纯碱、空气 | D. | 金刚石、熟石灰、石油 |
| 序号 | 需区分物质 | 方法一 | 方法二 |
| A | 空气和氧气 | 用带火星木条检验 | 闻气味 |
| B | 真黄金和假黄金(铜锌合金) | 观察颜色 | 加热 |
| C | 铁粉和炭粉 | 用磁铁吸引 | 加稀硫酸 |
| D | 氢氧化钠溶液和碳酸钠溶液 | 用无色酚酞溶液试液 | 加稀盐酸 |
| A. | A | B. | B | C. | C | D. | D |
| A. | NaHCO3和NH4Cl都是氮肥 | B. | NaHCO3中碳元素的化合价是+4 | ||
| C. | CO2、H2O和NaHCO3都是氧化物 | D. | 这个化学反应属于复分解反应 |
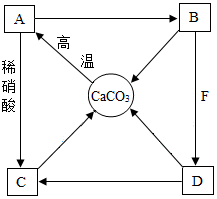 A~F是初中化学常见物质,A、B、C、D和CaCO3均含有同一种元素,其中B常用于改良酸性土壤,胃液中含有F.它们之间的转化关系如图所示,“→”表示相互转化.请回答:
A~F是初中化学常见物质,A、B、C、D和CaCO3均含有同一种元素,其中B常用于改良酸性土壤,胃液中含有F.它们之间的转化关系如图所示,“→”表示相互转化.请回答: