题目内容
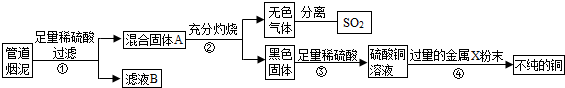
某金属冶炼厂的管道烟泥中含有某些单质,其中Cu约占10.3%、Zn约占5.0%、S约占1.2%。现欲回收铜和锌,并对硫进行环保处理,主要步骤如下图所示:

(1)步骤①产生的废气A中,一定含有的有害气体是_____。
(2)步骤②中含铜元素的物质所发生反应的化学方程式是_____,溶液D中一定含有的溶质是____。
(3)步骤③中反应的化学方程式是_____。
(4)有人认为若步骤①中空气不足量,会导致锌的回收率降低,你认为是否正确?_____(填“正确”或“不正确”),理由是_____。
(1)SO2 (2)CuO + H2SO4 = CuSO4 +H2O ZnSO4、CuSO4、H2SO4
(3)Zn + CuSO4 = ZnSO4 + Cu、Zn + H2SO4 = ZnSO4 + H2↑
(4)不正确,由于稀硫酸过量,Zn和ZnO都能转化为ZnSO4,不影响锌的回收率。
【解析】
试题分析:(1)由于烟泥中含有S,故步骤①产生的废气A中,一定含有的有害气体是SO2。
(2)步骤①中Cu与氧气反应生成了氧化铜,故步骤②中含铜元素的物质所发生反应的化学方程式是CuO + H2SO4 = CuSO4 +H2O,由于步骤②中加入的稀硫酸过量,故溶液D中一定含有的溶质是ZnSO4、CuSO4、H2SO4。
(3)步骤③中反应的化学方程式是Zn + CuSO4 = ZnSO4 + Cu、Zn + H2SO4 = ZnSO4 + H2↑。
(4)若步骤①中空气不足量,会导致锌的回收率降低,该说法不正确,理由是由于稀硫酸过量,Zn和ZnO都能转化为ZnSO4,不影响锌的回收率。
考点:物质分离;化学方程式的书写;金属与酸反应。
点评:要分离物质,可以通过不同的化学反应,逐步的将各种物质分离;
书写化学方程式要遵循客观事实和质量守恒定律两个原则,注意化学式要正确,不要忘记反应条件、气体或者沉淀符号。

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案烟泥样品中部分元素质量分数表
| 编号 | Cu | Zn | S |
| 1 | 10.3% | 5.0% | 1.2% |
| 2 | 11.5% | 4.9% | 1.8% |
| 3 | 12.4% | 10.3% | 0.9% |

(1)写出步骤①②中含铜元素的物质发生反应的化学方程式:
①
(2)写出本方案中处理废气的方法(用化学方程式表示):
(3)步骤⑤中所用的操作方法是:
(4)在步骤④中,可选用试剂