题目内容
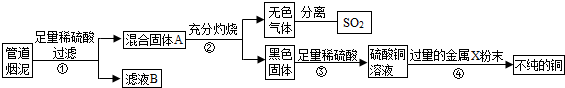
某金属冶炼厂的管道烟泥中含有炭黑及金属铜和锌.综合实践活动小组的同学设计了从管道烟泥中回收金属铜的实验方案,实验过程如图所示:

请回答:
(1)步骤①中,过滤操作使用了玻璃棒,其作用是
(2)步骤④中,所加入的金属X与Zn的活动性顺序是Zn>X,而且金属X是当今世界上产量最高用途最广泛的金属,X是
(3)除去不纯铜中的杂质金属X,可选用的试剂有
(4)在进行“反应①”“反应③”“反应④”操作时,可将反应物加入

请回答:
(1)步骤①中,过滤操作使用了玻璃棒,其作用是
引流
引流
;在过滤时,实践活动小组的同学发现过滤速度很慢,原因可能是滤纸没有紧贴漏斗内壁
滤纸没有紧贴漏斗内壁
(填一种可能的情况).滤液B中的溶质有硫酸锌
硫酸锌
(填一种).(2)步骤④中,所加入的金属X与Zn的活动性顺序是Zn>X,而且金属X是当今世界上产量最高用途最广泛的金属,X是
Fe
Fe
,该反应的化学方程式是CuSO4+Fe═Cu+FeSO4
CuSO4+Fe═Cu+FeSO4
.(3)除去不纯铜中的杂质金属X,可选用的试剂有
稀盐酸
稀盐酸
(填一种).(4)在进行“反应①”“反应③”“反应④”操作时,可将反应物加入
烧杯
烧杯
中(填仪器名称),然后玻璃棒搅拌
玻璃棒搅拌
(填操作名称),使反应充分进行.分析:(1)依据过滤中玻璃棒的引流作用分析判断,依据铜锌混合物与稀硫酸反应时铜不能参与分析判断;
(2)依据金属活动性顺序结合金属X具有广泛用途分析该金属是铁,并得到相关的方程式;
(3)依据铁铜的性质对两者进行分离即可;
(4)较多量固体与液体反应可在烧杯内进行,为使反应充分进行可用玻璃棒搅拌.
(2)依据金属活动性顺序结合金属X具有广泛用途分析该金属是铁,并得到相关的方程式;
(3)依据铁铜的性质对两者进行分离即可;
(4)较多量固体与液体反应可在烧杯内进行,为使反应充分进行可用玻璃棒搅拌.
解答:解:(1)在过滤操作中玻璃棒起到引流的作用,以防止液体飞溅,过滤时要注意滤纸紧贴漏斗内壁,否则过滤速度减慢.由于锌的活动性在氢前,铜的活动性在氢后,所以铜锌混合物与稀硫酸反应时,铜不能参与反应,碳也不能反应,而锌与稀硫酸反应会生成硫酸锌,所以过滤时滤液是硫酸锌,固体A是铜与炭黑的混合物;
(2)经过步骤②碳加热生成二氧化碳,铜加热生成氧化铜,氧化铜经步骤③转化成硫酸铜的溶液,硫酸铜加过量的x铜说明x的活动性比铜强,由条件金属X与Zn的活动性顺序是Zn>X,金属X具有广泛用途知X是金属铁,反应是铁与硫酸铜发生置换反应,方程式为:CuSO4+Fe═Cu+FeSO4.
(3)除去铜中混有的铁,可加稀盐酸,铁与盐酸反应而铜不能反应
(4)较多量固体与液体反应可在烧杯内进行,为使反应充分进行可用玻璃棒搅拌.
故答案为:(1)引流;滤纸没有紧贴漏斗内壁 硫酸锌;(2)Fe;CuSO4+Fe═Cu+FeSO4;(3)稀盐酸(4)烧杯 玻璃棒搅拌
(2)经过步骤②碳加热生成二氧化碳,铜加热生成氧化铜,氧化铜经步骤③转化成硫酸铜的溶液,硫酸铜加过量的x铜说明x的活动性比铜强,由条件金属X与Zn的活动性顺序是Zn>X,金属X具有广泛用途知X是金属铁,反应是铁与硫酸铜发生置换反应,方程式为:CuSO4+Fe═Cu+FeSO4.
(3)除去铜中混有的铁,可加稀盐酸,铁与盐酸反应而铜不能反应
(4)较多量固体与液体反应可在烧杯内进行,为使反应充分进行可用玻璃棒搅拌.
故答案为:(1)引流;滤纸没有紧贴漏斗内壁 硫酸锌;(2)Fe;CuSO4+Fe═Cu+FeSO4;(3)稀盐酸(4)烧杯 玻璃棒搅拌
点评:此题是一道常规的资源回收题,解题的方法是对设计方案所涉及的化学反应要能明确,并进而对反应物生成物作出判断,此题属基础性回收实验题.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
某金属冶炼厂的管道烟泥中含有某些金属,随 机取样对烟泥进行分析.由右表中的数据可知,在烟泥中含有相当量的铜、锌以及能造成污染的硫.因此从效益和环保角度出发,应考虑把铜、锌回收利用,并对硫进行适当的处理.
烟泥样品中部分元素质量分数表
[设计方案]
(1)写出步骤①②中含铜元素的物质发生反应的化学方程式:
① 、② .
(2)写出本方案中处理废气的方法(用化学方程式表示): .
(3)步骤⑤中所用的操作方法是: .
(4)在步骤④中,可选用试剂 从混合溶液A中得到铜.
烟泥样品中部分元素质量分数表
| 编号 | Cu | Zn | S |
| 1 | 10.3% | 5.0% | 1.2% |
| 2 | 11.5% | 4.9% | 1.8% |
| 3 | 12.4% | 10.3% | 0.9% |

(1)写出步骤①②中含铜元素的物质发生反应的化学方程式:
①
(2)写出本方案中处理废气的方法(用化学方程式表示):
(3)步骤⑤中所用的操作方法是:
(4)在步骤④中,可选用试剂