题目内容
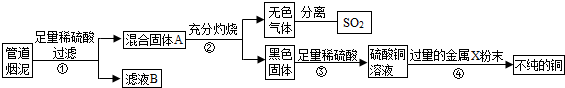
29、某金属冶炼厂的管道烟泥中含有某些单质,其中Cu约占10.3%、Zn约占5.0%、S约占1.2%.现欲回收铜和锌,并对硫进行环保处理,主要步骤如下图所示:

(1)步骤①产生的废气A中,会造成酸雨的是
(2)步骤②中含铜元素的物质所发生反应的化学方程式是
(3)步骤③中反应的化学方程式是
(4)有人认为若步骤①中空气不足量,会导致锌的回收率降低,你认为是否正确?

(1)步骤①产生的废气A中,会造成酸雨的是
二氧化硫
.(2)步骤②中含铜元素的物质所发生反应的化学方程式是
CuO+H2SO4═CuSO4+H2O
.(3)步骤③中反应的化学方程式是
Zn+H2SO4═ZnSO4+H2↑
、Zn+CuSO4═ZnSO4+Cu
.(4)有人认为若步骤①中空气不足量,会导致锌的回收率降低,你认为是否正确?
不正确
(填“正确”或“不正确”),理由是空气量不足,铜不能全部被氧气氧化,造成铜的回收率降低,锌的回收率不变
.分析:根据题干提供的信息进行分析,煤泥中含有的硫能与空气中的氧气反应生成二氧化硫,能形成酸雨,通入空气后,铜会与氧气反应生成氧化铜,氧化铜能与硫酸反应生成硫酸铜和水,硫酸过量,加入的锌粉能与硫酸反应生成硫酸锌和氢气,硫酸铜能与锌反应生成硫酸锌和铜.
解答:解:(1)煤泥中含有的硫能与空气中的氧气反应生成二氧化硫,能形成酸雨,所以本题答案为:二氧化硫;
(2)铜与氧气反应生成的氧化铜能与硫酸反应生成硫酸铜和水,所以本题答案为:CuO+H2SO4═CuSO4+H2O;
(3)溶液D中含有过量的硫酸和硫酸铜,加入适量的甲后,得到了铜和硫酸锌,所以甲是锌,锌能与硫酸反应生成硫酸锌和氢气,能与硫酸铜反应生成硫酸锌和铜,所以本题答案为:Zn+H2SO4═ZnSO4+H2↑,Zn+CuSO4═ZnSO4+Cu;
(4)通入空气是为了将混合物中的铜转化为氧化铜,从而将铜除去,锌不参与反应,故不会导致锌的回收率降低,所以本题答案为:不正确,空气量不足,铜不能全部被氧气氧化,造成铜的回收率降低,锌的回收率不变.
(2)铜与氧气反应生成的氧化铜能与硫酸反应生成硫酸铜和水,所以本题答案为:CuO+H2SO4═CuSO4+H2O;
(3)溶液D中含有过量的硫酸和硫酸铜,加入适量的甲后,得到了铜和硫酸锌,所以甲是锌,锌能与硫酸反应生成硫酸锌和氢气,能与硫酸铜反应生成硫酸锌和铜,所以本题答案为:Zn+H2SO4═ZnSO4+H2↑,Zn+CuSO4═ZnSO4+Cu;
(4)通入空气是为了将混合物中的铜转化为氧化铜,从而将铜除去,锌不参与反应,故不会导致锌的回收率降低,所以本题答案为:不正确,空气量不足,铜不能全部被氧气氧化,造成铜的回收率降低,锌的回收率不变.
点评:本题考查了金属回收的知识,完成此题,可以依据已有的知识结合题干提供的信息进行,书写反应的化学方程式时要注意配平.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
某金属冶炼厂的管道烟泥中含有某些金属,随 机取样对烟泥进行分析.由右表中的数据可知,在烟泥中含有相当量的铜、锌以及能造成污染的硫.因此从效益和环保角度出发,应考虑把铜、锌回收利用,并对硫进行适当的处理.
烟泥样品中部分元素质量分数表
[设计方案]
(1)写出步骤①②中含铜元素的物质发生反应的化学方程式:
① 、② .
(2)写出本方案中处理废气的方法(用化学方程式表示): .
(3)步骤⑤中所用的操作方法是: .
(4)在步骤④中,可选用试剂 从混合溶液A中得到铜.
烟泥样品中部分元素质量分数表
| 编号 | Cu | Zn | S |
| 1 | 10.3% | 5.0% | 1.2% |
| 2 | 11.5% | 4.9% | 1.8% |
| 3 | 12.4% | 10.3% | 0.9% |

(1)写出步骤①②中含铜元素的物质发生反应的化学方程式:
①
(2)写出本方案中处理废气的方法(用化学方程式表示):
(3)步骤⑤中所用的操作方法是:
(4)在步骤④中,可选用试剂