题目内容
同学们在实验室发现了一包白色粉末状物质,经询问老师侯,知道可能是NaCl、Na2SO4、Na2CO3、BaCl2、CuSO4、中的一种或几种.为了确定这包粉末的成分,同学们进行了以下实验:
【查阅质料】BaCO3是一种白色难溶物.
(1)甲同学取少量白色粉末溶于足量水中,得到无色溶液,由此得出的结论:该粉末一定不含有
(2)乙同学在上述无色溶液中加入过量的盐酸,有无色气体放出,结论:此粉末中一定含有 ,一定不含有 .
(3)丙同学在乙同学的基础上加入足量的BaCl2溶液,出现了白色沉淀,结论:此粉末中一定含有 ,反应方程式为 .
(4)丁同学对丙同学试验后的混合物进行了 操作,然后在溶液中加入少量AgNO3溶液,结果有出现了白色沉淀,丁同学认为这包粉末中还含有NaCL.同学们认为丁同学的结论不正确,你认为他们的理由是 通过实验,同学们加深了对复分解反应的理解.
【查阅质料】BaCO3是一种白色难溶物.
(1)甲同学取少量白色粉末溶于足量水中,得到无色溶液,由此得出的结论:该粉末一定不含有
(2)乙同学在上述无色溶液中加入过量的盐酸,有无色气体放出,结论:此粉末中一定含有
(3)丙同学在乙同学的基础上加入足量的BaCl2溶液,出现了白色沉淀,结论:此粉末中一定含有
(4)丁同学对丙同学试验后的混合物进行了
考点:物质的鉴别、推断,酸的化学性质,盐的化学性质
专题:混合物组成的推断题
分析:根据题中所给的各种物质都溶于水,硫酸铜在溶液中显蓝色,盐酸和碳酸钠会生成二氧化碳气体,碳酸根离子和钡离子会生成碳酸钡沉淀,硫酸根离子和钡离子会生成硫酸钡沉淀,过滤操作可以将固体和液体分离,氯离子和银离子会生成氯化银沉淀等知识进行分析.
解答:解:题中所给的各种物质都溶于水,硫酸铜在溶液中显蓝色,盐酸和碳酸钠会生成二氧化碳气体,碳酸根离子和钡离子会生成碳酸钡沉淀,硫酸根离子和钡离子会生成硫酸钡沉淀,过滤操作可以将固体和液体分离,氯离子和银离子会生成氯化银沉淀.
(1)甲同学取少量白色粉末溶于足量水中,得到无色溶液,硫酸铜在溶液中显蓝色,所以由此得出的结论:该粉末一定不含有:CuSO4;
(2)乙同学在上述无色溶液中加入过量的盐酸,有无色气体放出,碳酸钠和盐酸会生成二氧化碳气体,所以此粉末中一定含有:Na2CO3,碳酸钠和氯化钡会生成白色沉淀,所以一定不含有:BaCl2;
(3)丙同学在乙同学的基础上加入足量的BaCl2溶液,出现了白色沉淀,氯化钡和硫酸钠会生成白色的硫酸钡沉淀,所以此粉末中一定含有:Na2SO4,反应方程式为:Na2SO4+BaCl2=BaSO4↓+2NaCl;
(4)过滤操作可以将液体和固体分离,丁同学对丙同学试验后的混合物分离后得到了固体和液体,所以该同学进行了过滤操作,在(3)中加入了氯化钡溶液,会引入氯离子,即使没有氯化钠,加入硝酸银后,也会生成白色沉淀,所以他们的理由是:氯化钡溶液也会引入氯离子.
故答案为:(1)CuSO4;
(2)Na2CO3,BaCl2;
(3)Na2SO4,Na2SO4+BaCl2=BaSO4↓+2NaCl;
(4)氯化钡溶液也会引入氯离子.
(1)甲同学取少量白色粉末溶于足量水中,得到无色溶液,硫酸铜在溶液中显蓝色,所以由此得出的结论:该粉末一定不含有:CuSO4;
(2)乙同学在上述无色溶液中加入过量的盐酸,有无色气体放出,碳酸钠和盐酸会生成二氧化碳气体,所以此粉末中一定含有:Na2CO3,碳酸钠和氯化钡会生成白色沉淀,所以一定不含有:BaCl2;
(3)丙同学在乙同学的基础上加入足量的BaCl2溶液,出现了白色沉淀,氯化钡和硫酸钠会生成白色的硫酸钡沉淀,所以此粉末中一定含有:Na2SO4,反应方程式为:Na2SO4+BaCl2=BaSO4↓+2NaCl;
(4)过滤操作可以将液体和固体分离,丁同学对丙同学试验后的混合物分离后得到了固体和液体,所以该同学进行了过滤操作,在(3)中加入了氯化钡溶液,会引入氯离子,即使没有氯化钠,加入硝酸银后,也会生成白色沉淀,所以他们的理由是:氯化钡溶液也会引入氯离子.
故答案为:(1)CuSO4;
(2)Na2CO3,BaCl2;
(3)Na2SO4,Na2SO4+BaCl2=BaSO4↓+2NaCl;
(4)氯化钡溶液也会引入氯离子.
点评:在解此类题时,首先分析题中所给物质的性质,然后依据题中的现象确定各种物质的存在性,最后确定混合物的成分.

练习册系列答案
相关题目
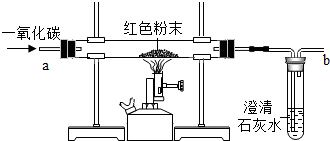 (一)在实验探究课上,老师给了同学们一包红色粉未,该粉末是铜粉和和氧化铁粉中的一种或两种.同学们为了确定该粉末的成分,进行如下探究.请你参与他们的探究并回答问题.
(一)在实验探究课上,老师给了同学们一包红色粉未,该粉末是铜粉和和氧化铁粉中的一种或两种.同学们为了确定该粉末的成分,进行如下探究.请你参与他们的探究并回答问题. 如图是A、B、C三种物质的溶解度随温度变化的曲线图.根据图回答:
如图是A、B、C三种物质的溶解度随温度变化的曲线图.根据图回答: 为探究碱的性质,进行如下实验.
为探究碱的性质,进行如下实验.