题目内容
11.取10g锌粉和铜粉的混合物于烧杯中,向烧杯中分四次加入等质量的同种稀硫酸,实验过程中得到如下数据:| 实验次数 | 第1次 | 第2次 | 第3次 | 第4次 |
| 加入稀硫酸的质量/g | 20 | 20 | 20 | 20 |
| 剩余固体的质量/g | 8.7 | 7.4 | 6.1 | 5.5 |
(2)计算所用稀硫酸中溶质的质量分数.
分析 由前三次可以看出,每加入20g硫酸固体减少了1.3g,所以第四次理论上也应该减少1.3g,而第四次只减少了0.6g,所以应该是锌已经完全反应,剩余的固体为5.5g的铜.进而结合每20g稀硫酸反应1.3g的锌结合化学方程式求算20g稀硫酸中溶质的质量,进而求算其质量分数.
解答 解:由前三次可以看出,每加入20g硫酸固体减少了1.3g,所以第四次理论上也应该减少1.3g,而第四次只减少了0.6g,所以应该是锌已经完全反应,剩余的固体为5.5g的铜.
每20g稀硫酸反应1.3g的锌,设20g稀硫酸中溶质的质量为x
Zn+H2SO4=ZnSO4+H2↑
65 98
1.3g x
$\frac{65}{98}$=$\frac{1.3g}{x}$
x=1.96g
所用稀硫酸中溶质的质量分数是$\frac{1.96g}{20g}$×100%=9.8%
答:(1)混合物中铜粉的质量是 5.5g.
(2)所用稀硫酸中溶质的质量分数为9.8%.
点评 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整.

练习册系列答案
相关题目
1.金秋十月,人们站在桂花旁能闻到怡人的桂花香,这一现象说明了( )
| A. | 分子是保持物质化学性质的最小粒子 | |
| B. | 分子裂为原子 | |
| C. | 分子在不断地运动 | |
| D. | 分子之间有间隔 |
2. 中国最新战机歼-31使用了高强度、耐高温的钛合金材料.工业上冶炼钛的反应如下:TiCl4+2Mg $\frac{\underline{\;高温\;}}{\;}$Ti+2MgCl2.该反应属于( )
中国最新战机歼-31使用了高强度、耐高温的钛合金材料.工业上冶炼钛的反应如下:TiCl4+2Mg $\frac{\underline{\;高温\;}}{\;}$Ti+2MgCl2.该反应属于( )
 中国最新战机歼-31使用了高强度、耐高温的钛合金材料.工业上冶炼钛的反应如下:TiCl4+2Mg $\frac{\underline{\;高温\;}}{\;}$Ti+2MgCl2.该反应属于( )
中国最新战机歼-31使用了高强度、耐高温的钛合金材料.工业上冶炼钛的反应如下:TiCl4+2Mg $\frac{\underline{\;高温\;}}{\;}$Ti+2MgCl2.该反应属于( )| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
6.化学来源于生活,下列做法中不合理的是( )
| A. | 用小苏打烘焙糕点 | |
| B. | 用灼烧并闻气味的方法区别纯棉织物和纯毛织物 | |
| C. | 用熟石灰改良酸性土壤 | |
| D. | 以天然气为燃料不会对自然界中的碳循环产生影响 |
3.下列做法安全的是( )
| A. | 电器着火直接用泡沫灭火器扑灭 | |
| B. | 沾在手上的浓硫酸用氢氧化钠溶液中和 | |
| C. | 点燃可燃性气体前要验纯 | |
| D. | 厨房内天然气泄漏立即开启排风扇 |
20.下列不能正确反映相关实验过程中量的变化关系的图象是( )
| A. |  NaOH溶液加水稀释 | |
| B. |  一定压强下,氧气在水中的溶解度 | |
| C. |  在一定温度下向不饱和硝酸钾溶液中加入硝酸钾 | |
| D. |  加热氯酸钾制氧气:a.有催化剂b.无催化剂 |
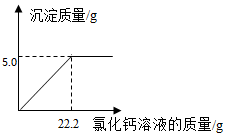 为测定某纯碱样品(含少量的氯化钠)中碳酸钠的含量,小明称取该纯碱样品6.0g,充份溶解于水中,再滴加氯化钙溶液,产生沉淀的质量与加人氯化钙溶液的质量关系如图所示,求:(结果精确到0.1%)
为测定某纯碱样品(含少量的氯化钠)中碳酸钠的含量,小明称取该纯碱样品6.0g,充份溶解于水中,再滴加氯化钙溶液,产生沉淀的质量与加人氯化钙溶液的质量关系如图所示,求:(结果精确到0.1%) 如图是中学化学中常见物质间的转化关系,A与B常温下反应放出大量热,A常温为液体,F与H组成元素相同,E是红色粉末(反应条件,部分反应物和生成物均已略去)
如图是中学化学中常见物质间的转化关系,A与B常温下反应放出大量热,A常温为液体,F与H组成元素相同,E是红色粉末(反应条件,部分反应物和生成物均已略去)