题目内容
6.某化学兴趣小组有一次活动的内容是:对一包干燥的红色粉末组成进行探究请你参与并回答有关问题.【教师提醒】它由Cu、Fe2O3、Fe(OH)3三种固体中的一种或两种组成.
【提出猜想】红色粉末可能的组成有:
①只有Cu ②只有Fe2O3 ③只有Fe(OH)3④是Fe2O3与Fe(OH)3的混合物
⑤是Cu与Fe2O3的混合物 ⑥是Cu与Fe(OH)3的混合物
【资料获悉】
(1)2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O
(2)白色无水CuSO4遇水变蓝;
(3)Cu在FeCl3溶液中发生反应:2FeCl3+Cu═2FeCl2+CuCl2.
【探究思路】利用物质的性质不同设计实验加以甄别,先分别探究其中是否含有Fe(OH)3、Cu等,逐步缩小范围,然后再选择适当的试剂和方法通过实验探究其组成.(装置内空气中的水蒸气、CO2忽略不计)
【实验探究】
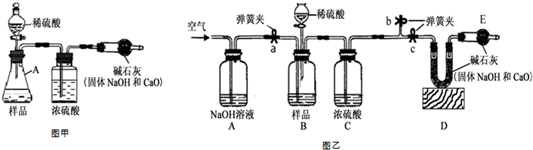
(1)甲同学取适量红色粉末装入试管中,按图1进行实验.结果无水CuSO4没有变蓝,从而排除猜想中的③④⑥(填猜想中的序号).

(2)在甲同学实验结论的基础上,乙同学另取少量红色粉末于试管中,滴加足量稀盐酸,振荡后观察,发现固体全部溶解,溶液变色.乙同学认为可以排除猜想中的①和⑤,而丙同学认为只能排除猜想①,你认为丙的观点正确(填“乙”或“丙”).
(3)丁同学为进一步确定红色粉末的组成,称取该粉末5.0g装入硬质玻璃管中,按上面右图在通风橱中进行实验.开始时缓缓通入CO气体,过一段时间后再加热使其充分反应.待反应完全后,停止加热,仍继续通CO气体直至玻璃管冷却.反应前后称量相关装置和物质的总质量,其数据如表:
| 反应前 | 反应后 | |
| Ⅰ组 | 玻璃管和红色粉末的总质量为37.3g | 玻璃管和固体物质的总质量为36.1g |
| Ⅱ组 | 洗气瓶和所盛溶液的总质量为180.0g | 洗气瓶和瓶中物质的总质量为183.1g |
(1)中先通CO气体的作用是排净装置中的空气.
(2)选择Ⅰ组的实验数据计算来确定红色粉末的组成.最终计算结果表明:该红色粉末的组成是猜想中的第⑤组(填序号).
(3)A装置中发生反应的化学方程式3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;实验中观察到A装置中的现象为部分红色粉末变黑.
(4)为了防止溶液倒吸,本实验停止加热前是否需要先断开A和B的连接处?不需要(填“需要”或“不需要”),理由是因为一直通入CO气体,B中溶液不会倒吸到A装置中.
【反思评价】戊同学指出:从环保角度,图2装置有严重不足之处.你认为应该如何改进?在B装置后放一燃着的酒精灯将剩余气体烧掉.
【拓展延伸】有同学提出丁同学上述实验中的CO还可以用H2代替,并将上面右图中B装置换成盛有碱石灰(生石灰和氢氧化钠固体混合物)的干燥管,来确定该红色粉末的组成,你认为是否可行?可行(填“可行”或“不可行”).
分析 本题是一道综合性探究题,利用物质的性质不同设计实验加以甄别,来探究红色粉末的组成,先分别探究其中是否含有Fe(OH)3、Cu等,逐步缩小范围,然后再选择适当的试剂和方法通过实验探究确定其组成.
根据【资料获悉】中的(1)(2)(3)和探究(1)可排除猜想中的 ③④⑥,
根据【资料获悉】(3)和探究(2)可排除猜想中的①,故红色粉末可能是Fe2O3 或Cu、Fe2O3的混合物,探究(3)利用了一氧化碳的还原性和定量实验来确定是否有铜.
探究(3)要考虑到CO具有可燃性,与玻璃管中的空气混合受热会发生爆炸,因此,应先通CO排尽玻璃管中的空气,然后再加热.应考虑到CO有毒,排放到空气中会污染大气,显然,该装置没有对尾气进行处理.
在探究的同时也出现了与上述高考题中相同的防倒吸及尾气处理等考点.同时考查了一氧化碳还原氧化铁的实验操作要点实验现象等,对氢气的还原性也进行了衍生.
解答 解:【实验探究】
(1)根据资料 2Fe(OH)3 $\frac{\underline{\;\;△\;\;}}{\;}$ Fe2O3+3H2O,白色无水CuSO4遇水变蓝;加热红色粉末,结果无水CuSO4没有变蓝,从而排除猜想中的含有Fe(OH)3的选项③④⑥;故答案为:③④⑥;
(2)根据资料:Cu在FeCl3溶液中发生反应:2FeCl3+Cu=2FeCl2+CuCl2 ;取红色粉末于试管中,滴加足量稀盐酸,振荡后观察,发现固体全部溶解,溶液变色,可推断排除猜想中的①,故红色粉末可能是Fe2O3 或Cu、Fe2O3的混合物;
所以说丙同学的观点正确;故答案为:丙;
【交流讨论】
(1)根据CO具有可燃性,与玻璃管中的空气混合受热会发生爆炸,因此,应先通CO排尽玻璃管中的空气,然后再加热.所以在装置A中先通CO气体的作用是:排净装置中的空气(或防止CO和装置中的空气混合受热发生爆炸);
故答案为:排净装置中的空气(或防止CO和装置中的空气混合受热发生爆炸);
(2)第Ⅱ组数据,不能证明二氧化碳完全反应;应该选择Ⅰ组的实验数据计算来确定红色粉末的组成.根据极值法计算法,最终计算结果表明:该红色粉末的组成是猜想中的第⑤组;故答案为:Ⅰ;⑤;
(3)A装置中发生反应的化学方程式为:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;红色粉末是Cu、Fe2O3的混合物,因此实验中观察到A装置中的现象为:部分红色粉末变黑;
故答案为:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;部分红色粉末变黑;
(4)因为在反应中一直通入CO气体直至冷却,B中溶液不会倒吸到A装置中.故答案为:不需要;因为一直通入CO气体,B中溶液不会倒吸到A装置中;
【反思评价】
此反应应考虑到CO有毒,排放到空气中会污染大气,显然,该装置没有对尾气进行处理;所以图装置有严重不足之处.改进方法为:在B装置后放一燃着的酒精灯将剩余气体烧掉(或用塑料袋等收集);
故答案为:在B装置后放一燃着的酒精灯将剩余气体烧掉(或用塑料袋等收集);
【拓展延伸】:CO还可以用H2代替,B装置换成盛有碱石灰(生石灰和氢氧化钠固体混合物)的干燥管,来确定该红色粉末的组成,可行;故答案为:可行.
点评 此类题目主要对炼铁的实验原理、实验现象、操作步骤、尾气处理、装置连接及实验分析与评价等方面进行考查.熟练掌握该实验的反应原理以及实验注意事项是解决此类问题的关键.


| A. | 图示中共有四种分子 | B. | 说明化学反应中原子可分 | ||
| C. | 该反应为置换反应 | D. | 该反应不符合质量守恒定律 |