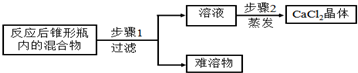
题目内容
10. 以下是初中化学有关铁的性质的一些基本实验,请回答问题.
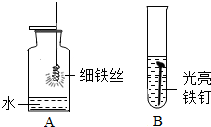
以下是初中化学有关铁的性质的一些基本实验,请回答问题.(1)某同学用O2做A实验,在引燃的火柴即将燃尽时将细铁丝插入集气瓶中,未观察到剧烈燃烧,火星四射现象,其原因可能是铁丝表面有锈(或氧气浓度低)(写出一条).
(2)若B中为稀盐酸,则发生反应的基本类型为置换反应;若B中为水,一段时间后,产物主要成分的化学式为Fe2O3.
分析 (1)根据铁丝在氧气中燃烧的实验方面进行分析、判断,从而得出正确的结论;
(2)根据铁与稀盐酸反应的现象,进行分析解答;根据铁与氧气、水共同作用生成铁锈,结合化学式的书写方法分析;
解答 解:(1)在引燃的火柴快燃尽时将细铁丝插入集气瓶中,未观察到剧烈燃烧,火星四射现象,原因可能是用排空气法收集氧气时空气未完全排净,氧气浓度较小,也有可能是细铁丝表面有铁锈,铁不能与氧气充分接触;
(2)若B中为稀盐酸,铁与稀盐酸反应生成氯化亚铁和氢气,则发生反应的基本类型为置换反应;若B中为水,铁与氧气、水共同作用生成铁锈,一段时间后,产物主要成分的化学式为Fe2O3.
故答案为:
(1)铁丝表面有锈(或氧气浓度低); (2)①置换反应; ②Fe2O3.
点评 并非每个实验都能成功,会做实验的同时,还要学会分析实验失败的原因.熟记和理解金属的性质及用途、常见金属的特性及其应用、金属活动性顺序及其应用等相关知识,才能顺利解题.

练习册系列答案
相关题目
1.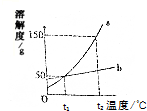 如图是a、b两种固体物质(不含结晶冰)的溶解度曲线,下列叙述错误的是( )
如图是a、b两种固体物质(不含结晶冰)的溶解度曲线,下列叙述错误的是( )
 如图是a、b两种固体物质(不含结晶冰)的溶解度曲线,下列叙述错误的是( )
如图是a、b两种固体物质(不含结晶冰)的溶解度曲线,下列叙述错误的是( )| A. | t2℃时,a的溶解度大于b的溶解度 | |
| B. | t2℃时,a的饱和溶液的溶质的质量分数为t1℃时的3倍 | |
| C. | b中含有少量a,可以用恒温蒸发溶剂的方法提纯b | |
| D. | t1℃时,等质量的a、b两种物质的饱和溶液中溶质质量一定相等 |
1.下列分析正确的是( )
| A. | 铁钉浸入硫酸铜溶液中,铁钉变红,铁没有铜活泼 | |
| B. | 氢气通入灼热的氧化铜粉末中,红色粉末变黑,氢气具有还原性 | |
| C. | 向汗液中滴入硝酸银溶液和稀硝酸,产生白色沉淀,汗液中含有氯离子 | |
| D. | 纯碱与盐酸混合,有气泡产生,纯碱与盐酸发生中和反应 |
18. 同学们通过查阅资料知道,过氧化氢分解反应的催化剂除二氧化锰外,还有氯化镁溶液、氯化铜溶液中的金属离子和土豆中含有的过氧化氢酶以及氧化铜等.
同学们通过查阅资料知道,过氧化氢分解反应的催化剂除二氧化锰外,还有氯化镁溶液、氯化铜溶液中的金属离子和土豆中含有的过氧化氢酶以及氧化铜等.
方案Ⅰ:分别取20mL 5%的过氧化氢溶液于3个大小相同的锥形瓶中.向其中两个锥形瓶中分别加入含相同数目金属离子的氯化铁溶液和氯化铜溶液,分别连接传感器测体系压强(如图所示).测定数据如下表所示:
(1)加入含相同数目金属离子的氯化铁溶液和氯化铜溶液,该步操作的实验目的是控制金属离子的数目,对比它们对过氧化氢分解速率的影响.
(2)根据上表数据得出的结论是(写一个)氯化铁溶液催化产生氧气的速率比氯化铜溶液快.
方案Ⅱ:从同一部位取2个质量均为1.7g的正方体土豆块,将其中一块切成若干片,片与片相连不断开,同时分别放入盛30mL 5%过氧化氢溶液的50mL量筒中.均看到有气泡生成,一段时间,只有土豆片不断上升.通过实验得出的结论是反应物和催化剂的接触面接越大,反应速率越快.
(3)请写出该反应的化学方程式2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑.
[实验反思]
(4)通过实验一和实验二说明,测量不同的物理量可判断过氧化氢的分解速率.除此之外,本实验还可以用其他方法比较过氧化氢的分解速率,下列说法中不合理的是A(填选项序号).
A.测量完全反应后气体的总体积 B.测量相同时间内产生气体的体积
C.测量相同时间内体系压强的变化 D.测量相同时间内溶液质量的变化
(5)小明发现实验过程中锥形瓶外壁发烫,而过氧化氢的分解速率开始时会逐渐增大.查阅资料后得知:过氧化氢分解时会放出大量的热,你能不能据此解释其分解速率发生变化的原因?过氧化氢分解时放出热量,温度升高,反应速率加快
(6)你还能想到对过氧化氢溶液的分解速率产生影响的其他因素吗?请选择一种,设计实验加以验证过氧化氢溶液的浓度影响分解速率:
实验步骤:室温下,取相同质量的二氧化锰粉末分别加入两支规格相同的试管中,再分别同时加入相同体积、浓度不同的过氧化氢溶液,连接收集装置;
实验现象:浓度大的过氧化氢溶液产生气泡的速率较快,相同时间内浓度大的过氧化氢溶液收集装置中收集的气体体积大;
实验结论:其它条件相同时,过氧化氢溶液的浓度越大,分解速率越快.
 同学们通过查阅资料知道,过氧化氢分解反应的催化剂除二氧化锰外,还有氯化镁溶液、氯化铜溶液中的金属离子和土豆中含有的过氧化氢酶以及氧化铜等.
同学们通过查阅资料知道,过氧化氢分解反应的催化剂除二氧化锰外,还有氯化镁溶液、氯化铜溶液中的金属离子和土豆中含有的过氧化氢酶以及氧化铜等.方案Ⅰ:分别取20mL 5%的过氧化氢溶液于3个大小相同的锥形瓶中.向其中两个锥形瓶中分别加入含相同数目金属离子的氯化铁溶液和氯化铜溶液,分别连接传感器测体系压强(如图所示).测定数据如下表所示:
| 时间/s 试剂 压强/KPa | 0 | 60 | 120 | 180 | 240 | 300 |
| 20mL5%的过氧化氢溶液 | 101.86 | 102.99 | 103.42 | 103.67 | 103.99 | 104.00 |
| 加入氯化铁溶液 | 102.21 | 105.35 | 115.40 | 129.69 | 145.52 | 163.99 |
| 加入氯化铜溶液 | 101.50 | 102.73 | 107.53 | 114.78 | 122.49 | 130.39 |
(2)根据上表数据得出的结论是(写一个)氯化铁溶液催化产生氧气的速率比氯化铜溶液快.
方案Ⅱ:从同一部位取2个质量均为1.7g的正方体土豆块,将其中一块切成若干片,片与片相连不断开,同时分别放入盛30mL 5%过氧化氢溶液的50mL量筒中.均看到有气泡生成,一段时间,只有土豆片不断上升.通过实验得出的结论是反应物和催化剂的接触面接越大,反应速率越快.
(3)请写出该反应的化学方程式2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑.
[实验反思]
(4)通过实验一和实验二说明,测量不同的物理量可判断过氧化氢的分解速率.除此之外,本实验还可以用其他方法比较过氧化氢的分解速率,下列说法中不合理的是A(填选项序号).
A.测量完全反应后气体的总体积 B.测量相同时间内产生气体的体积
C.测量相同时间内体系压强的变化 D.测量相同时间内溶液质量的变化
(5)小明发现实验过程中锥形瓶外壁发烫,而过氧化氢的分解速率开始时会逐渐增大.查阅资料后得知:过氧化氢分解时会放出大量的热,你能不能据此解释其分解速率发生变化的原因?过氧化氢分解时放出热量,温度升高,反应速率加快
(6)你还能想到对过氧化氢溶液的分解速率产生影响的其他因素吗?请选择一种,设计实验加以验证过氧化氢溶液的浓度影响分解速率:
实验步骤:室温下,取相同质量的二氧化锰粉末分别加入两支规格相同的试管中,再分别同时加入相同体积、浓度不同的过氧化氢溶液,连接收集装置;
实验现象:浓度大的过氧化氢溶液产生气泡的速率较快,相同时间内浓度大的过氧化氢溶液收集装置中收集的气体体积大;
实验结论:其它条件相同时,过氧化氢溶液的浓度越大,分解速率越快.
5.下列有关物质的比较推理中,正确的是( )
| A. | 稀硫酸和盐酸是不同的酸,所以化学性质完全不同 | |
| B. | H2O2与H2O都含氢氧元素,所以化学性质相同 | |
| C. | CuO和Fe2O3都是金属氧化物,所以都能与酸反应 | |
| D. | NaCl和NaNO2都是有咸味的盐,所以都可做调味品 |
2.下列实验现象描述不正确的是( )
| A. | 电解水时正极产生的气体的体积比负极产生的气体体积多 | |
| B. | 硫在空气中燃烧,产生淡蓝色火焰 | |
| C. | 细铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体 | |
| D. | 铜绿受热分解,固体由绿色变为黑色 |
20.下列各组物质在水中能大量共存,并能形成无色溶液的是( )
| A. | NaCl、CuSO4、Na2CO3 | B. | Ca(OH)2、HCl、CaCO3 | ||
| C. | CaCO3、NaOH、KNO3 | D. | NaCl、Na2SO4、HCl |
 ”和“
”和“ ”分别表示氮原子和氧原子,下图是此反应的微观模拟图:
”分别表示氮原子和氧原子,下图是此反应的微观模拟图: