题目内容
17.如图所示各项实验中,所用试剂及实验操作均正确的是( )| A. |  制取CO2 | B. |  加热固体 | ||
| C. |  制取氧气 | D. |  除去O2中的水蒸气 |
分析 A、根据实验室制取二氧化碳的实验装置、注意事项,进行分析判断.
B、根据给试管中的固体加热的方法进行分析判断.
C、根据实验室制取氧气的反应原理、注意事项,进行分析判断.
D、根据浓硫酸具有吸水性,进行分析判断.
解答 解:A、实验室中制取二氧化碳常用大理石或石灰石和稀盐酸反应来制取,不能使用稀硫酸,块状石灰石和稀硫酸反应生成微溶于水的硫酸钙,会覆盖在石灰石的表面,阻止反应的进行,图中所示操作错误.
B、给试管中的固体加热时,为防止冷凝水回流到热的试管底部,试管口应略向下倾斜,图中所示操作错误.
C、双氧水在二氧化锰的催化作用下生成水和氧气,属于固液常温型,氧气的密度比空气的大,不能用向下排空气法收集,图中所示操作错误.
D、浓硫酸具有吸水性,且不与氧气反应,图中装置起洗气功能时进气管与出气管的方向是“长进短出”,图中所示操作正确.
故选:D.
点评 本题难度不大,熟悉各种仪器的用途及使用注意事项、常见化学实验基本操作的注意事项是解答此类试题的关键.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
7.如表所示,实验室用过氧化氢溶液和二氧化锰制取氧气,实验的有关数据如下:
(1)反应中二氧化锰的作用是催化作用
(2)反应生成氧气的质量为0.8g(结果精确到0.1g,下同)
(3)计算参加反应的过氧化氢的质量,写出必要的计算过程.
| 气体发生装置内物质的总质量(g) | |
| 反应前 | 35.6 |
| 反应后 | 34.8 |
(2)反应生成氧气的质量为0.8g(结果精确到0.1g,下同)
(3)计算参加反应的过氧化氢的质量,写出必要的计算过程.
8.下列关于实验现象的描述,正确的是( )
| A. | 硫在空气中燃烧,产生明亮的蓝紫色火焰,生成一种有刺激性气味的气体 | |
| B. | 红磷在空气中燃烧时产生大量白色烟雾 | |
| C. | 加热氧化铜与木炭的混合物,红色粉末变黑,产生使澄清石灰水变浑浊的气体 | |
| D. | 向试管中的镁条滴加稀盐酸后,迅速产生大量气泡,同时试管壁发热 |
5.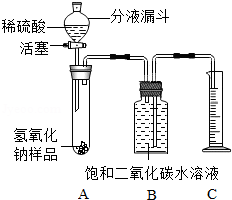 某化学课外小组的同学,为了测定实验室中一瓶因保存不善而部分变质的氢氧化钠中碳酸钠的质量分数,设计了如图所示的装置(图中铁架台已经略去),实验在27℃,101kPa下进行.
某化学课外小组的同学,为了测定实验室中一瓶因保存不善而部分变质的氢氧化钠中碳酸钠的质量分数,设计了如图所示的装置(图中铁架台已经略去),实验在27℃,101kPa下进行.
实验步骤如下:
①按图连接好装置;
②用天平准确称取氢氧化钠样品m g,放入A中试管内,向B中集气瓶内倒入饱和二氧化碳水溶液至瓶颈处;
③向分液漏斗中倒入稀硫酸,打开活塞,让稀硫酸滴入试管中至过量,关闭活塞.反应结束后,量筒中收集到饱和二氧化碳水溶液v mL.
④计算氢氧化钠样品中碳酸钠的质量分数.
请回答下列问题:
(1)准确判断氢氧化钠发生变质的实验现象是A中有气泡产生;写出氢氧化钠发生变质的化学方程式2NaOH+CO2═Na2CO3+H2O.
(2)在实验步骤①和②之间,还缺少一实验步骤,该实验步骤是:检查装置气密性.
(3)B中集气瓶盛装的饱和二氧化碳水溶液不能用水代替,其原因是:避免二氧化碳溶解在水里而损耗,造成测定结果偏低.
(4)判断实验步骤③中滴入的稀硫酸已过量的标志是滴入稀硫酸,A中不再有气泡产生.
(5)叙述检验氢氧化钠部分变质的方法:
(6)用上述装置不能准确测定已部分变质的氢氧化钠样品中氢氧化钠的质量分数,理由是氢氧化钠样品中除了碳酸钠,还有水.
(7)取10g变质的氢氧化钠于烧杯中,其中碳元素的质量分数为6%,向烧杯中加入100g一定质量分数的稀盐酸(足量),则反应结束后烧杯内物质的总质量是107.8g.
 某化学课外小组的同学,为了测定实验室中一瓶因保存不善而部分变质的氢氧化钠中碳酸钠的质量分数,设计了如图所示的装置(图中铁架台已经略去),实验在27℃,101kPa下进行.
某化学课外小组的同学,为了测定实验室中一瓶因保存不善而部分变质的氢氧化钠中碳酸钠的质量分数,设计了如图所示的装置(图中铁架台已经略去),实验在27℃,101kPa下进行.实验步骤如下:
①按图连接好装置;
②用天平准确称取氢氧化钠样品m g,放入A中试管内,向B中集气瓶内倒入饱和二氧化碳水溶液至瓶颈处;
③向分液漏斗中倒入稀硫酸,打开活塞,让稀硫酸滴入试管中至过量,关闭活塞.反应结束后,量筒中收集到饱和二氧化碳水溶液v mL.
④计算氢氧化钠样品中碳酸钠的质量分数.
请回答下列问题:
(1)准确判断氢氧化钠发生变质的实验现象是A中有气泡产生;写出氢氧化钠发生变质的化学方程式2NaOH+CO2═Na2CO3+H2O.
(2)在实验步骤①和②之间,还缺少一实验步骤,该实验步骤是:检查装置气密性.
(3)B中集气瓶盛装的饱和二氧化碳水溶液不能用水代替,其原因是:避免二氧化碳溶解在水里而损耗,造成测定结果偏低.
(4)判断实验步骤③中滴入的稀硫酸已过量的标志是滴入稀硫酸,A中不再有气泡产生.
(5)叙述检验氢氧化钠部分变质的方法:
| 实验步骤 | 实验现象 | 实验结论 |
| 1取样,溶于水,滴加过量的氯化钙溶液 | 产生白色沉淀 | 氢氧化钠部分变质 |
| 2静置,向上层清液中滴加酚酞溶液 | 变红色 |
(7)取10g变质的氢氧化钠于烧杯中,其中碳元素的质量分数为6%,向烧杯中加入100g一定质量分数的稀盐酸(足量),则反应结束后烧杯内物质的总质量是107.8g.
12.对于化学反应“甲+乙=丙+丁”,下列说法中错误的是( )
| A. | 若生成物丙和丁分别是盐和水,则反应物一定是酸和碱 | |
| B. | 若甲和丙是单质,乙和丁是化合物,则该反应一定属于置换反应 | |
| C. | 若甲、乙、丙均是化合物,则该反应不一定属于复分解反应 | |
| D. | 若甲、乙各取10g混合,使其充分反应,则丙、丁质量的总和不一定等于20g |
 某同学构建了如图所示的转化关系图,其中甲、乙、丙、丁四种物质均含有碳元素,乙和丙的组成元素相同,乙中碳元素的质量分数约为27.27%.请回答下列问题:
某同学构建了如图所示的转化关系图,其中甲、乙、丙、丁四种物质均含有碳元素,乙和丙的组成元素相同,乙中碳元素的质量分数约为27.27%.请回答下列问题:
 为探究铁锈蚀的影响因素,某兴趣小组做了如下实验.
为探究铁锈蚀的影响因素,某兴趣小组做了如下实验.