题目内容
9.实验结束时,同学们将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里,如果将废液直接排放就会造成水污染.于是几位同学利用课余处理废液,回收工业重要原料硫酸锌和有关金属.实验过程如图: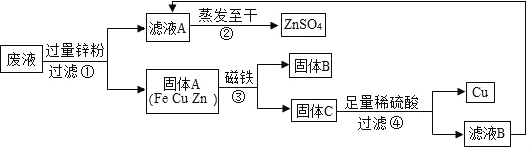
请回答:
(1)滤液A和滤液B含有相同的溶质,其名称是硫酸锌;固体B的化学式为Fe.
(2)写出步骤①其中一个反应的化学方程式Zn+CuSO4=ZnSO4+Cu或Zn+FeSO4═ZnSO4+Fe;步骤④发生反应的化学方程式为Zn+H2SO4=ZnSO4+H2↑.
(3)要检验步骤④中加入的稀硫酸是否足量的方法是取步骤④的滤渣于试管中加入少量稀硫酸,若有气泡产生则酸不足量.
步骤④也可以把稀硫酸换成硫酸铜溶液,写出反应方程式-Zn+CuSO4=ZnSO4+Cu.
分析 (1)由题意可知:②中蒸发至干,得硫酸锌;因为滤液A和滤液B含有相同的溶质,所以步骤④中加入的稀硫酸,得硫酸锌;
(2)根据题中的信息,推导出反应物和生产物,正确书写化学方程式;
(3)检验加入的稀硫酸是否足量:取步骤④的滤渣于试管中加入少量稀硫酸,若有气泡产生则酸不足量(或若无气泡产生,则酸已足量),即铁与稀硫酸反应,锌和硫酸铜反应生成硫酸亚铁和铜进行分析.
解答 解:(1)利用金属活动性顺序,回收工业重要原料硫酸锌和有关金属;
(2)根据题中的信息,推导出反应物和生产物,利用金属活动性顺序,正确书写化学方程式;故步骤①其中一个反应的化学方程式 Zn+CuSO4=ZnSO4+Cu 或Zn+FeSO4═ZnSO4+Fe;步骤④发生反应的化学方程式为 Zn+H2SO4=ZnSO4+H2↑;
(3)检验加入的稀硫酸是否足量:取步骤④的滤渣于试管中加入少量稀硫酸,若有气泡产生则酸不足量(或若无气泡产生,则酸已足量),即由题意可推知铁与稀硫酸反应; 锌和硫酸铜反应生成硫酸亚铁和铜,化学方程式为:Zn+CuSO4=ZnSO4+Cu.
故答案为:(1)硫酸锌,Fe;
(2)Zn+CuSO4=ZnSO4+Cu 或Zn+FeSO4═ZnSO4+Fe;Zn+H2SO4=ZnSO4+H2↑;
(3)取步骤④的滤渣于试管中加入少量稀硫酸,若有气泡产生则酸不足量,Zn+CuSO4=ZnSO4+Cu.
点评 仔细审题,有题意可知一些信息,根据信息推导做题;利用金属活动性顺序,回收工业重要原料硫酸锌和有关金属.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.不久前,日本某一材料研究所的科学家发明了一种“碳纳米管温度计”,这种温度计被认定是目前世界上最小的温度计.研究人员在长约10-6m,直径为10-7m的碳纳米管中充入液态的金属镓.当温度升高时,管中镓就会膨胀,通过电子显微镜就能读取温度值.这种温度计测量的范围可从30℃到490℃,并且精确度较高,可用于检查电子线路是否异常、测量毛细血管的温度等许多方面.根据以上信息判断下列推测中正确的是( )
| A. | 金属镓的熔点、沸点都很低 | |
| B. | 在30℃到490℃之间金属镓的体积与温度变化呈正比 | |
| C. | 碳纳米管的体积在10℃至500℃之间随温度变化很小,可忽略不计 | |
| D. | 金属镓的体积在30℃到490℃之间随温度变化很小,可忽略不计 |
20.物质的性质决定用途,下列说法不正确的是( )
| A. | 氢氧化钠可以作食品干燥剂 | B. | 干冰可以用于人工降雨 | ||
| C. | 稀硫酸可以除铁锈 | D. | 氯化钠可以配制生理盐水 |
1.除去如表物质中的少量物质,所用试剂或方法不正确的是( )
| 选项 | 物质 | 杂质 | 试剂或方法 |
| A | O2 | CO2 | 通过灼热的Cu |
| B | CaO固体 | CaCO3固体 | 高温灼烧 |
| C | NaCl固体 | MnO2固体 | 溶解、过滤、蒸发 |
| D | FeSO4溶液 | H2SO4溶液 | 铁粉 |
| A. | A | B. | B | C. | C | D. | D |
18.把锌片放入下列溶液中,反应一段时间后,所得溶液的质量比原溶液的质量减小 的是( )
| A. | 稀硫酸 | B. | 硝酸银溶液 | C. | 硫酸铜溶液 | D. | 硫酸亚铁溶液 |
 食品保鲜可以防止食品腐坏,保持食品的营养和味道.食品保鲜的措施有添加防腐剂、填充气体、放置干燥剂和脱氧保鲜剂等.
食品保鲜可以防止食品腐坏,保持食品的营养和味道.食品保鲜的措施有添加防腐剂、填充气体、放置干燥剂和脱氧保鲜剂等. 水是生命之源,也是人类最宝贵的资源.
水是生命之源,也是人类最宝贵的资源. (
( 表示氯原子,
表示氯原子, 表示氧原子,
表示氧原子, 表示氢原子)该反应的化学方程式为H2O+Cl2═HClO+HCl,其中化合价发生变化的元素为氯元素.
表示氢原子)该反应的化学方程式为H2O+Cl2═HClO+HCl,其中化合价发生变化的元素为氯元素.