题目内容
6.某面包膨松剂是由碳酸氢钠和碳酸氢铵两种物质组成,化学小组为验证该膨松剂中含有碳酸氢铵并测量其含量,查阅资料,并设计了如图所示实验.[资料]①膨松剂在面包制作过程中发生化学反应:
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑
NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O+CO2↑
②通常状况下,1体积水溶解700体积氨气,氨气溶于水所得溶液称氨水.
[操作]装置气密性良好,测得反应前所加膨松剂样品质饼为m1g,先关闭k2,打开k1并加热,一段时间后改关闭k1打开2并直至实验结束,冷却至室温后测A中试管内剩余固体质量为m2g.
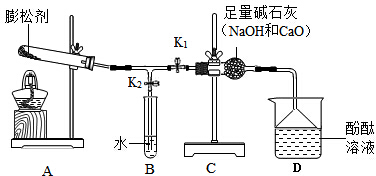
试回答以下相关问题:
(1)检验膨松剂中有碳酸氢铵依据实验现象是D中酚酞变红色.
(2)C装置的作用是吸收水和二氧化碳,如果没有C装置,可能对实验造成影响D装置中可能看不到变红现象,不能判断有氨气生成.
(3)如何判断样品已反应完全B中不再有气泡产生.
(4)样品中氨酸氢铵质量分数$\frac{{m}_{1}-\frac{84}{53}{m}_{2}}{{m}_{1}}$×100%.
(5)反应结束后接下来应该进行的正确实验操作是先关闭k2,然后熄灭酒精灯.
分析 (1)根据氨气溶于水,溶液显碱性,氨水能使酚酞变红色进行分析;
(2)根据D装置的作用是用来检验是否产生氨气的,而二氧化碳溶于水形成碳酸,可以和氨水发生反应进行分析;
(3)根据剩余固体是碳酸钠的质量,然后计算碳酸氢钠的质量,进而计算碳酸氢铵的质量分数进行分析;
(4)根据B中的水可能发生倒吸进行分析.
解答 解:(1)氨气溶于水,溶液显碱性,氨水能使酚酞变红色,所以检验膨松剂中有碳酸氢铵依据实验现象是D中酚酞变红色;
(2)D装置的作用是用来检验是否产生氨气的,而二氧化碳溶于水形成碳酸,可以和氨水发生反应,从而可能看不到D装置中的现象,而C装置中的氢氧化钠和氧化钙可以吸收二氧化碳,从而避免了二氧化碳干扰实验现象;
(3)剩余固体是碳酸钠的质量,然后计算碳酸氢钠的质量,进而计算碳酸氢铵的质量分数所以
设参加反应的碳酸氢钠的质量为x
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑
168 106
x m2g
$\frac{168}{x}$=$\frac{106}{{m}_{2}g}$
x=$\frac{84}{53}$m2,
所以样品中氨酸氢铵质量分数为:$\frac{{m}_{1}-\frac{84}{53}{m}_{2}}{{m}_{1}}$×100%;
(4)B中的水可能发生倒吸,所以反应结束后接下来应该进行的正确实验操作是:先关闭k2,然后熄灭酒精灯.
故答案为:(1)D中酚酞变红色;
(2)吸收二氧化碳和水,D装置中可能看不到变红现象,不能判断有氨气生成;
(3)$\frac{{m}_{1}-\frac{84}{53}{m}_{2}}{{m}_{1}}$×100%;
(4)先关闭k2,然后熄灭酒精灯.
点评 根据实验的装置图及所提供资料的分析,正确理解实验的目的及出现现象的原因,对于解答此新知识的探究型问题是尤其重要的.

 阅读快车系列答案
阅读快车系列答案【提出问题】剩余固体成分是什么?
【猜想与假设】剩余固体成分为:
A、全部是碳酸钙 B、全部是氧化钙 C、①既有碳酸钙,也有氧化钙
【设计并完成实】
| 实验操作 | 实验现象 | 实验结论 |
| (1)取少量固体于试管中,加适量水振荡后静置,再滴几滴无色酚酞试液 | 溶液变红 | 说明固体成分中一定含有②氧化钙 |
| (2)再取少量固体于另一试管中滴加过量稀盐酸 | 有气泡生成 | 说明固体成分中一定含有③碳酸钙 |
【交流与反思】实验操作(2)中产生的气体是⑤二氧化碳,该气体有何作用:⑥灭火、制冷、降雨、制饮料、做气体肥料(进行光合作用)、制造舞台烟雾等(写一种即可).
| A. | 不慎将浓硫酸沾到皮肤上,应立即用稀氨水冲洗,再涂上硼酸溶液 | |
| B. | 氢氧化钠有强烈的腐蚀性,实验使用时,最好戴上防护眼镜 | |
| C. | 酒精灯失火应立刻用灭火器扑灭 | |
| D. | 为了便于观察,给试管里的液体加热使试管口应对着自己 |
| 实验序号 | 反应物质量/g | 生成物质量/g | |
| X | Y | Z | |
| ① | 7.2 | 1.6 | 8.0 |
| ② | 8.0 | 2.4 | 10.0 |
(2)X+Y→Z的反应中,反应物X、Y与生成物Z的质量比为4:1:5.
(3)若将①和②的反应物混合,最多可生成产物C.
A.18g B.18.8g C.19.0g D.19.2g.
 如图是甲、乙两种物质的溶解度曲线,甲、乙物质从溶液中析出时不含结晶水,请 回答下列问题:
如图是甲、乙两种物质的溶解度曲线,甲、乙物质从溶液中析出时不含结晶水,请 回答下列问题:
 根据图中a、b、c三种固体物质的溶解度曲线,回答下列问题:
根据图中a、b、c三种固体物质的溶解度曲线,回答下列问题: 在学习盐的化学性质时,老师将一定量的碳酸钠溶液与氯化钙溶液混合,过滤反应后的混合物,老师要求同学们探究滤液中溶质的组成.回答有关问题:
在学习盐的化学性质时,老师将一定量的碳酸钠溶液与氯化钙溶液混合,过滤反应后的混合物,老师要求同学们探究滤液中溶质的组成.回答有关问题: