题目内容
甲同学设计了以贝壳(主要成分是碳酸钙,杂质不参加反应且不溶于水)和纯碱为原料制取烧碱的实验,过程如下.
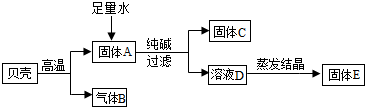
①高温煅烧贝壳时发生反应的化学方程式是 .
②固体E的成分存在 种可能.为测定其成分,取少量固体E,放入足量稀盐酸中,有气泡产生,则固体E的成分是 .
③为得到较纯净的烧碱,乙同学提出了两个方案
方案一,除去固体E中的杂质:将固体E溶解,加入适量 溶液,过滤,将滤液蒸发结晶.
方案二,重新实验:通过称量固体 的质量,计算并加入适量纯碱.

①高温煅烧贝壳时发生反应的化学方程式是
②固体E的成分存在
③为得到较纯净的烧碱,乙同学提出了两个方案
方案一,除去固体E中的杂质:将固体E溶解,加入适量
方案二,重新实验:通过称量固体
考点:物质的相互转化和制备,碳酸钙、生石灰、熟石灰之间的转化,酸的化学性质,书写化学方程式、文字表达式、电离方程式
专题:物质的制备
分析:①根据化学方程式的书写方法考虑;②根据碳酸钠与氢氧化钙反应后溶质的判断方法考虑,碳酸盐与盐酸反应能产生二氧化碳;③根据除杂质的方法:不能引入新的杂质,加入的试剂只能与杂质反应.
解答:解:①反应物是碳酸钙,生成物是氧化钙和二氧化碳,反应条件是高温,二氧化碳后面标上上升符号,所以方程式是:CaCO3
CaO+CO2↑;
②如果氢氧化钙与碳酸钠恰好完全反应,固体E只有氢氧化钠,如果碳酸钠过量,则固体E是氢氧化钠和碳酸钠的混合物,如果氢氧化钙过量,则固体E是氢氧化钠和氢氧化钙的混合物,所以有3种可能;取少量固体E,放入足量稀盐酸中,有气泡产生,说明存在碳酸盐,所以固体E成分是氢氧化钠和碳酸钠的混合物;
③方案一,除去氢氧化钠中的碳酸钠,可以加入氢氧化钙,由于氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,没有引入新的杂质;
方案二,通过称量固体贝壳和固体A的质量,利用质量差是生成的二氧化碳的质量,根据二氧化碳质量计算出生成的氧化钙的质量,进而计算出生成的氢氧化钙的质量,再计算出需要碳酸钠的质量即可.
故答案为:①CaCO3
CaO+CO2↑;②3;碳酸钠、氢氧化钠;③氢氧化钙(氢氧化钡);贝壳和固体A.
| ||
②如果氢氧化钙与碳酸钠恰好完全反应,固体E只有氢氧化钠,如果碳酸钠过量,则固体E是氢氧化钠和碳酸钠的混合物,如果氢氧化钙过量,则固体E是氢氧化钠和氢氧化钙的混合物,所以有3种可能;取少量固体E,放入足量稀盐酸中,有气泡产生,说明存在碳酸盐,所以固体E成分是氢氧化钠和碳酸钠的混合物;
③方案一,除去氢氧化钠中的碳酸钠,可以加入氢氧化钙,由于氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,没有引入新的杂质;
方案二,通过称量固体贝壳和固体A的质量,利用质量差是生成的二氧化碳的质量,根据二氧化碳质量计算出生成的氧化钙的质量,进而计算出生成的氢氧化钙的质量,再计算出需要碳酸钠的质量即可.
故答案为:①CaCO3
| ||
点评:解答本题关键是要知道判断两种物质反应后所得溶液中溶质质量时,不仅要考虑生成物,还需要考虑反应物过量问题.

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
如图是某粒子的结构示意图.下列有关叙述不正确的是( )


| A、该粒子的最外层电子数为16 |
| B、该粒子的第一层有2个电子 |
| C、该粒子的原子序数为16 |
| D、在化学反应中该粒子容易得到2个电子 |
夏季汽车轮胎容易发生爆炸,这是因为轮胎内的气体分子( )
| A、体积增大 | B、质量增大 |
| C、间隔增大 | D、个数增多 |
 A、B、C、D、E分别是甲烷、氢气、氧气、氧化铜和水中的一种物质.通常情况下D为固体.如图用圆和方框表示这五种物质,用两圆相切表示两种物质可以发生化学反应.用“→”表示一种物质能转化为另一种物质.请回答下列问题:
A、B、C、D、E分别是甲烷、氢气、氧气、氧化铜和水中的一种物质.通常情况下D为固体.如图用圆和方框表示这五种物质,用两圆相切表示两种物质可以发生化学反应.用“→”表示一种物质能转化为另一种物质.请回答下列问题:
 在实验探究课上,老师给了同学们一包红色粉未,该粉末是铜粉和氧化铁粉中的一种或两种.同学们为了确定该粉末的成分,进行如下探究.请你参与他们的探究并回答问题.
在实验探究课上,老师给了同学们一包红色粉未,该粉末是铜粉和氧化铁粉中的一种或两种.同学们为了确定该粉末的成分,进行如下探究.请你参与他们的探究并回答问题.