题目内容
12.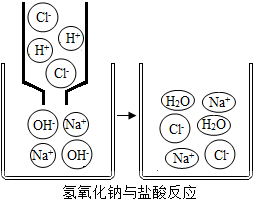 今有①肥皂水 ②食盐水 ③杨梅汁 ④白糖水 ⑤蒸馏水,5种液体,根据你的生活经验判断,其中pH<7的是③,pH>7的是①,pH=7的是②④⑤(填序号).右图是氢氧化钠与盐酸反应的微观示意图,请仔细观察、分析此图,写出一条你从图中获取的信息(用文字或化学用语表述)氢氧化钠与盐酸反应的实质是氢离子与氢氧根离子反应生成水.
今有①肥皂水 ②食盐水 ③杨梅汁 ④白糖水 ⑤蒸馏水,5种液体,根据你的生活经验判断,其中pH<7的是③,pH>7的是①,pH=7的是②④⑤(填序号).右图是氢氧化钠与盐酸反应的微观示意图,请仔细观察、分析此图,写出一条你从图中获取的信息(用文字或化学用语表述)氢氧化钠与盐酸反应的实质是氢离子与氢氧根离子反应生成水.
分析 当溶液的pH等于7时,呈中性;当溶液的pH小于7时,呈酸性;当溶液的pH大于7时,呈碱性;据此结合常见物质的酸碱性进行分析判断即可.根据微观模拟图,结合图例的说明,判断反应中各物质的电离产物,或者二者的反应过程及反应的实质等.
解答 解:①肥皂水显碱性,pH>7;②食盐水、④白糖水、⑤蒸馏水均显中性,pH均等于7;③杨梅汁显酸性,pH<7.
从微观示意图中可以看出,盐酸在水溶液中解离成氢离子和氯离子;氢氧化钠在水溶液中解离成钠离子和氢氧根离子;氯化钠在水溶液中解离成钠离子和氯离子;氢氧化钠与盐酸反应的实质是氢离子与氢氧根离子反应生成水;还可写出二者反应的化学方程式为:NaOH+HCl═NaCl+H2O;
故答案为:③;①;②④⑤;氢氧化钠与盐酸反应的实质是氢离子与氢氧根离子反应生成水.
点评 本题难度不大,掌握常见物质的酸碱性、溶液的酸碱性和溶液pH大小之间的关系是顺利解题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.下列图示的实验装置或操作正确的是( )
| A. |  点燃镁条 | B. |  铁丝在氧气中燃烧 | ||
| C. |  收集氧气 | D. |  探究空气中氧气的含量 |
7.有关溶液的说法正确的是( )
| A. | 溶液中的溶质一定是固体 | B. | 溶液一定是混合物 | ||
| C. | 溶液中上层浓度小,下层浓度大 | D. | 溶液一定是无色透明的 |
17. 为测定锌铜合金中锌的含量,取该合金放入如图 盛有稀硫酸的锥形瓶中,多次实验后,取平均值所得数据如下表:
为测定锌铜合金中锌的含量,取该合金放入如图 盛有稀硫酸的锥形瓶中,多次实验后,取平均值所得数据如下表:
若不考虑干燥剂吸收空气中的水蒸气,计算:
(1)计算该合金中锌的质量分数.
(2)如没有干燥装置,计算结果会偏大(填“偏大”、“偏小”,或“相等”)
 为测定锌铜合金中锌的含量,取该合金放入如图 盛有稀硫酸的锥形瓶中,多次实验后,取平均值所得数据如下表:
为测定锌铜合金中锌的含量,取该合金放入如图 盛有稀硫酸的锥形瓶中,多次实验后,取平均值所得数据如下表:| 反应前 | 充分反应后装置及反应剩余物质质量 | |
| 装置和足量的稀硫酸质量 | 锌铜合金质量 | |
| 342.10g | 16.00 | 357.70g |
(1)计算该合金中锌的质量分数.
(2)如没有干燥装置,计算结果会偏大(填“偏大”、“偏小”,或“相等”)
1.在一个密闭的容器内,有X、Y、Z、Q四种物质,在一定条件下充分反应,测得反应前各物质的质量如下:
(1)试推断该密闭容器中发生的化学反应类型为分解反应,
(2)反应的表达式可以写成Z→X+Y+Q.写出一个符合上述上述反应特点化学方程式2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑.
| 物质 | X | Y | Z | Q |
| 反应前质量/g | 2 | 2 | 84 | 5 |
| 反应后质量/g | 待测 | 24 | 0 | 14 |
(2)反应的表达式可以写成Z→X+Y+Q.写出一个符合上述上述反应特点化学方程式2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑.
19.实验室中能用来鉴别硬水、软水的最佳方法的是( )
| A. | 煮沸、过滤 | B. | 静止、沉淀 | C. | 加肥皂水搅拌 | D. | 吸附 |
 有一瓶无色气体,可能由甲烷、氢气、一氧化碳中的一种或两种或三种组成,为探究其组成情况,将气体点燃,并将燃烧后的产物通入下列装置中,请根据有关情况推测该气体的组成(提示:浓硫酸具有吸水性)
有一瓶无色气体,可能由甲烷、氢气、一氧化碳中的一种或两种或三种组成,为探究其组成情况,将气体点燃,并将燃烧后的产物通入下列装置中,请根据有关情况推测该气体的组成(提示:浓硫酸具有吸水性)