题目内容
17. 为测定AgNO3溶液中溶质的质量分数,某同学取一定质量的NaCl溶液,向其中加入200g AgNO3溶液,生成沉淀的质量与所加AgNO3溶液的质量关系如图所示.
为测定AgNO3溶液中溶质的质量分数,某同学取一定质量的NaCl溶液,向其中加入200g AgNO3溶液,生成沉淀的质量与所加AgNO3溶液的质量关系如图所示.分析并计算:
(1)M点所示溶液中的溶质是硝酸银、硝酸钠.
(2)AgNO3溶液中溶质的质量分数.
分析 硝酸银和氯化钠反应生成白色沉淀氯化银和硝酸钠,根据图中提供的信息和反应的化学方程式可以进行相关方面的计算和判断.
解答 解:(1)M点所示溶液中的溶质有硝酸银和氯化钠反应生成的硝酸钠和过量的硝酸银.
故填:硝酸银、硝酸钠.
(2)设100g硝酸银溶液中硝酸银质量为x,
NaCl+AgNO3═AgCl↓+NaNO3,
170 143.5
x 5.74g
$\frac{170}{x}$=$\frac{143.5}{5.74g}$,
x=6.8g,
AgNO3溶液中溶质的质量分数为:$\frac{6.8g}{100g}$×100%=6.8%,
答:AgNO3溶液中溶质的质量分数为6.8%.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.完全电解ag水,在正极上得到10mL气体,则在负极上得到的气体的质量和体积分别是( )
| A. | a g,10mL | B. | 8a/9 g,5 mL | C. | a/9 g,20mL | D. | a/9 g,5mL |
12.溶液在生产、生活中的应用非常广泛,请认真分析下列各图,回答相关问题.

(1)根据图Ⅰ分析,20℃时,将20gNaCl加入到50g水中形成溶液的质量为68g.
(2)如图Ⅱ所示,打开汽水瓶,冒出大量气泡,说明气体的溶解度与压强的关系是随压强的减小而减小.
(3)向图Ⅲ所示烧杯内的水中加入一定量的硝酸铵,溶解后甲试管内出现的现象是有固体析出;乙试管内溶液中溶质的质量分数不变(选填“变大”“变小”或“不变”).
(4)如表是氯化铵在不同温度时的溶解度.
20℃是按照图所示进行实验操作:

分析B中的溶液时饱和(选填“饱和”或“不饱和”)溶液,C中溶液溶质和溶剂的质量比为2:5.

(1)根据图Ⅰ分析,20℃时,将20gNaCl加入到50g水中形成溶液的质量为68g.
(2)如图Ⅱ所示,打开汽水瓶,冒出大量气泡,说明气体的溶解度与压强的关系是随压强的减小而减小.
(3)向图Ⅲ所示烧杯内的水中加入一定量的硝酸铵,溶解后甲试管内出现的现象是有固体析出;乙试管内溶液中溶质的质量分数不变(选填“变大”“变小”或“不变”).
(4)如表是氯化铵在不同温度时的溶解度.
| 温度/℃ | 0 | 20 | 40 | 60 |
| 溶解度/g | 29.4 | 37.2 | 45.8 | 55.2 |

分析B中的溶液时饱和(选填“饱和”或“不饱和”)溶液,C中溶液溶质和溶剂的质量比为2:5.
2.“接龙”是用化学扑克(和普通扑克相似,牌面标注物质的化学式)作为工具的一种游戏,其规则:当上家出牌时,下家跟出的牌所标注的物质必须能与上家的牌面所示物质反应.某局游戏中,甲到戊五人各有一张不同的牌,牌面标注“CuSO4”、“H2SO4”、“NaOH”、“Fe”、“Fe2O3”.若甲的牌为“Fe2O3”,且按甲-乙-丙-丁-戊依次出牌时能满足“接龙”规则,则戊的牌可能是( )
| A. | NaOH | B. | Fe | C. | CuSO4 | D. | H2SO4 |
6.下列关于分子的叙述中不正确的是( )
| A. | 我们不能直接看到空气中各种气态分子的存在,说明分子很小 | |
| B. | 将气态的C4H10液化,其分子的大小会发生了变化 | |
| C. | 无色气体和有色气体能够自动均匀混合,说明分子在不停地运动 | |
| D. | 空气中和纯净氧气中的氧分子化学性质完全相同 |
7.为检验塑料片中是否含有碳元素,可选用下列哪些实验仪器( )

| A. | ②③④ | B. | ①②③ | C. | ①② | D. | ②④ |

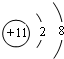 .
.