题目内容
14.乳酸亚铁[化学式为(C3H5O3)2Fe,溶于水可电离出乳酸根离子和亚铁离子]是常见补铁剂中的有效成分(其它成分不含铁),某实验小组为测定补铁剂中铁的质量分数,采用了如下实验步骤:第一步:取10克该补铁剂,在酸性条件下用双氧水把乳酸亚铁全部氧化成乳酸铁;
第二步:加入足量氨水和乳酸铁反应,观察到溶液中出现红褐色絮状沉淀,请写出该反应的化学方程式:(C3H5O3)3Fe+3NH3•H2O=Fe(OH)3↓+3NH4C3H5O3.
第三步:过滤、洗涤、干燥后得到纯净的沉淀,充分加热后未见明显的颜色变化,但称得质量减少了0.27克,则该补铁剂中铁的质量分数为5.6%.
分析 乳酸铁和氨水反应生成氢氧化铁沉淀和乳酸铵,氢氧化铁受热分解生成氧化铁和水,根据反应的化学方程式和提供的数据可以进行相关方面的计算.
解答 解:第二步:加入足量氨水和乳酸铁反应,观察到溶液中出现红褐色絮状沉淀,该反应的化学方程式为:
(C3H5O3)3Fe+3NH3•H2O=Fe(OH)3↓+3NH4C3H5O3.
故填:(C3H5O3)3Fe+3NH3•H2O=Fe(OH)3↓+3NH4C3H5O3.
第三步:设反应生成氧化铁质量为x,
称得质量减少了0.27克,说明反应生成了0.27g水;
2Fe(OH)3↓$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O,
160 54
x 0.27g
$\frac{160}{x}$=$\frac{54}{0.27g}$,
x=0.8g,
该补铁剂中铁元素质量为:0.8g×$\frac{112}{160}$×100%=0.56g,
则该补铁剂中铁的质量分数为:$\frac{0.56g}{10g}$×100%=5.6%,
故填:5.6%.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
5.根据你已有的化学知识和生活经验判断,下列说法不正确的是( )
| A. | 天然气、石油、煤都是不可再生资源 | |
| B. | 骨质疏松主要是人体缺钙造成的 | |
| C. | 蛋白质和糖类物质都是人体重要的供能物质 | |
| D. | 用燃烧的方法可以区分棉纤维和羊毛纤维 |
9.下列说法正确的是( )
| A. | 用碱石灰(生石灰和烧碱固体的混合物)可以干燥氨气 | |
| B. | 用硝酸银可以鉴别硫酸和盐酸 | |
| C. | 用无色酚酞可以检验氢氧化钠是否变质 | |
| D. | 金属钠放入硫酸铜溶液可以置换出单质铜 |
19.推理是一种重要的学习方法,下列推理正确的是( )
| A. | 磁感线既表示了磁场的分布,也表示了磁场的方向 | |
| B. | 水是由分子组成的,所以一切物质都是由分子组成 | |
| C. | 元素符号表示某种元素,所以不能表示某元素的原子 | |
| D. | 植物接受光照进行光合作用,所以不会进行呼吸作用 |
6.小李学习了水的有关知识后,自制了如图所示的简易净水器,下列说法正确的是( )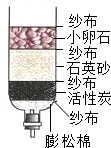

| A. | 该净水器可以降低自来水的硬度 | B. | 该净水器中的活性炭起吸附作用 | ||
| C. | 该净水器能起到杀菌消毒的作用 | D. | 该净水器可将自来水变为蒸馏水 |
3.分析推理是化学学习中常用的思维方法,下列分析推理正确的是( )
| A. | CO和CO2的分子构成不同,所以它们的化学性质有差异 | |
| B. | 离子是带电荷的微粒,所以带电荷的微粒一定是离子 | |
| C. | 酸雨的pH小于7,所以pH小于7的雨水一定是酸雨 | |
| D. | 有机物中都含有碳元素,所以含碳元素的物质都是有机物 |
3.以下是某研究小组探究影响化学反应快慢的一些因素的相关数据(常温通常指20℃)
(1)通过实验①和②对比可知,化学反应快慢与反应物的浓度有关;
(2)通过对比实验③和④可知,化学反应快慢与温度的关系是温度越高,化学反应的速率越快.
| 实验序号 | 过氧化氢溶液浓度/% | 过氧化氢溶液质量/g | 温度/℃ | 二氧化锰用量/g | 氧气体积/ml | 反应所需时间/s |
| ① | 5 | 12 | 20 | 0.2 | 125 | 11 |
| ② | 30 | 12 | 20 | 0.2 | 125 | 2 |
| ③ | 30 | 12 | 40 | / | 125 | 148 |
| ④ | 30 | 12 | 90 | / | 125 | 82 |
(2)通过对比实验③和④可知,化学反应快慢与温度的关系是温度越高,化学反应的速率越快.
