题目内容
15.为测定某黄铜样品中锌的含量,某同学称取20g黄铜(铜和锌的合金)样品于烧杯中,向其中加入稀硫酸至不再产生气泡为止,共消耗100g溶质质量分数为9.8%的稀硫酸.请计算:(1)该黄铜样品中锌的质量.
(2)反应后所得溶液的溶质质量分数(计算结果保留0.1%).
(3)若要用98%的浓硫酸来配制100g溶质质量分数为9.8%的稀硫酸需加水的质量.
分析 铜不能和稀硫酸反应,锌和稀硫酸反应生成硫酸锌和氢气,根据提供的数据可以进行相关方面的计算;
溶液稀释前后,溶质质量不变.
解答 解:(1)设锌的质量为x,生成硫酸锌的质量为y,生成氢气质量为z,
稀硫酸中硫酸质量为:100g×9.8%=9.8g,
Zn+H2SO4═ZnSO4+H2↑,
65 98 161 2
x 9.8g y z
$\frac{65}{x}$=$\frac{98}{9.8g}$=$\frac{161}{y}$=$\frac{2}{z}$,
x=6.5g,y=16.1g,z=0.2g,
答:该黄铜样品中锌的质量是6.5g.
(2)反应后所得溶液的溶质质量分数为:$\frac{16.1g}{6.5g+100g-0.2g}$×100%=15.1%,
答:反应后所得溶液的溶质质量分数是15.1%.
(3)需要浓硫酸质量为:9.8g÷98%=10g,
则需要水的质量为:100g-10g=90g,
答:需要水的质量是90g.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
6.推理是化学学习中常用的思维方法,下列推理正确的是( )
| A. | 氧化物中含有氧元素,所以含氧元素的化合物一定是氧化物 | |
| B. | 饱和溶液不能继续溶解某种溶质,则饱和溶液也不能继续溶解其他溶质 | |
| C. | 盐是由金属离子和酸根离子组成的,NH4NO3中没有金属离子,不属于盐 | |
| D. | 在金属活动性顺序里,位于氢前面的金属能置换出盐酸中的氢,所以铅能与盐酸反应 |
20.自然界中存在氧循环和碳循环,其中能将二氧化碳转化为氧气的是( )
| A. | 动植物的呼吸 | B. | 水的吸收 | ||
| C. | 绿色植物的光合作用 | D. | 煤和石油的燃烧 |
1.某气体可能含有水蒸气、CO、H2中的一种或几种.为了确定其成分,小科同学选用如图的甲、乙、丙三套实验装置进行探究.你认为最佳的实验方案是将气体依次通过装置 ( )
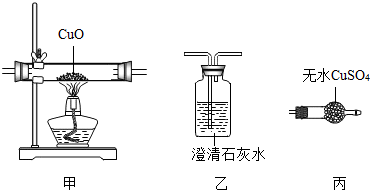

| A. | 甲、乙、丙 | B. | 丙、乙、甲 | C. | 丙、甲、乙、丙 | D. | 丙、甲、丙、乙 |
19.下列不属于有机物的是( )
| A. | 调味品食盐 | B. | 液化石油气的主要成分丙烷 | ||
| C. | 酱油中的蛋白质 | D. | 土豆中含有的淀粉 |

