题目内容
15.实骑室用大埋石和稀盐酸制取二氧化碳,反应结束后过虑得一无色溶液,为了研究所得溶液的成分,某小组同学取该溶液57.2g,向其中加入质量分数为10.6%的碳酸钠溶液,并测得反应过程中的pH变化,绘制如图1.请回答:(1)写出A-B过程发生反应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑;
(2)B-C过程的pH=7;
(3)B-C过程中与碳酸钠反应的物质(x)的比例为$\frac{106}{50g×10.6%}$=$\frac{111}{x}$;
(4)C点时溶液中溶质的质量分数为7.8%;
(5)请绘制出在加入碳酸钠的过程中产生沉淀的变化曲线图(如图2).

分析 (1)根据A-B过程中溶液的pH值逐渐上升,所以发生的反应盐酸和碳酸钠反应生成氯化钠、水和二氧化碳进行分析;
(2)根据B-C过程的反应是碳酸钠和氯化钙反应生成氯化钠和碳酸钙,溶液pH值不会改变,始终等于7进行分析;
(3)根据碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,依据碳酸钠的质量进行计算;
(4)根据碳酸钠和盐酸反应生成了氯化钠,碳酸钠和氯化钙反应也生成了氯化钠,依据元素守恒计算溶质的质量,依据质量守恒计算溶液的中了,然后计算溶质的质量分数;
(5)根据图象中的数据计算与氯化钙反应的碳酸钠的质量和生成沉淀的质量,然后进行作图.
解答 解:(1)A-B过程中溶液的pH值逐渐上升,所以发生的反应盐酸和碳酸钠反应生成氯化钠、水和二氧化碳,化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑;
(2)B-C过程的反应是碳酸钠和氯化钙反应生成氯化钠和碳酸钙,溶液pH值不会改变,始终等于7;
(3)设参加反应的氯化钙的质量为x,生成碳酸钙沉淀质量为y,生成氯化钠质量为z
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 111 100 117
50g×10.6% x y z
$\frac{106}{50g×10.6%}$=$\frac{111}{x}$=$\frac{100}{y}$=$\frac{117}{z}$
x=5.55g
y=5g
z=5.85g
(4)设碳酸钠和盐酸反应生成二氧化碳质量为m,生成氯化钠质量为n
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 117 44
50g×10.6% n m
$\frac{106}{50g×10.6%}$=$\frac{117}{n}$=$\frac{44}{m}$
m=2.2g
n=5.85g
所以C点时溶液中溶质的质量分数为$\frac{5.85g+5.85g}{57.2g+100g-2.2g-5g}$×100%=7.8%;
(5)通过分析可知,碳酸钠先于盐酸反应,然后再与氯化钙反应,当加入碳酸钠的质量大于50g时,开始生成碳酸钙沉淀,加入碳酸钠的质量为100g时,沉淀的质量达到了最大值5g,所以图象为
故答案为:(1)Na2CO3+2HCl=2NaCl+H2O+CO2↑;
(2)7;
(3)$\frac{106}{50g×10.6%}$=$\frac{111}{x}$;
(4)7.8%;
(5) .
.
点评 本题主要考查了化学方程式的计算,难度不大,注意解题的规范性和准确性.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 潮汐能 | B. | 太阳能 | C. | 石油 | D. | 风能 |
| A. | 澄清石灰水 | B. | 石油 | C. | 酱油 | D. | 冰水 |
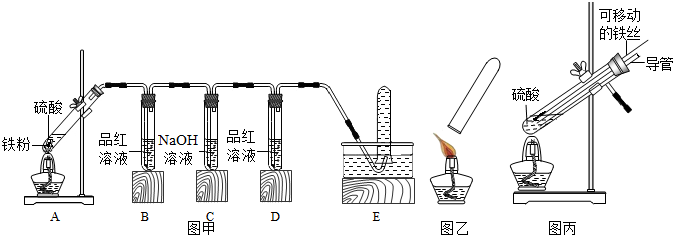
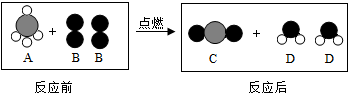
【提出问题】铁与硫酸溶液反应生成的气体为什么有刺激性气味?
【查阅资料】(1)2Fe+6H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$Fe2(SO4)3+3SO2↑+6H2O
(2)SO2可使品红溶液的红色褪去
【进行猜想】铁与不同浓度的硫酸溶液反应,生成的气体产物中可能有二氧化硫.
【实验探究】小明用图甲所示装置进行实验,并将E中收集到的气体进行如图乙所示的爆鸣实验.
请帮助小明完成下表:
| 实验现象 | |||||
| 硫酸溶液浓度 | B中品红溶液 | D中品红溶液 | 爆鸣实验 | A中生成气体成分 | |
| 实验一 | 98% | 褪色 | 不褪色 | 无爆鸣声 | 只有SO2 |
| 实验二 | 45% | 稍有褪色 | 不褪色 | 有爆鸣声 | 有SO2和H2 |
| 实验三 | 25% | 不褪色 | 不褪色 | 有爆鸣声 | 只有H2 |
【交流反思】(1)写出实验三中铁与硫酸溶液反应的化学方程式Fe+H2SO4═FeSO4+H2↑.
(2)实验一中C装置的作用是吸收二氧化硫.
【拓展延伸】小明将A装置进行了如图丙所示的改进,试分析:增加的导管下端伸入液面以下的原因形成液封,防止生成的气体逸出;该导管所起的作用是平衡试管内外的压强,防止停止加热时液体倒吸入试管.
| A. | 用甲醛溶液浸泡食品保鲜 | B. | 用熟石灰改良酸性土壤 | ||
| C. | 用干冰进行人工降雨 | D. | 用一氧化碳作燃料 |
| A. | 用托盘天平称取10.12g蔗糖 | B. | 用加热来降低水的硬度 | ||
| C. | 用pH试纸测定溶液pH值为5.6 | D. | 用碱石灰干燥二氧化碳 |
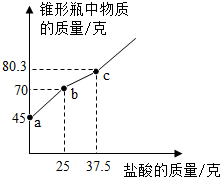 为测定某氢氧化钙(只含有碳酸钙杂质)样品的变质程度,称取研细的该样品12.4g放入锥形瓶中,加入32.6g水,充分振荡形成悬浊液,再向锥形瓶中逐滴滴加盐酸使其充分反应至无气泡产生,测得加入盐酸的质量与锥形瓶中物质的质量关系如图所示.
为测定某氢氧化钙(只含有碳酸钙杂质)样品的变质程度,称取研细的该样品12.4g放入锥形瓶中,加入32.6g水,充分振荡形成悬浊液,再向锥形瓶中逐滴滴加盐酸使其充分反应至无气泡产生,测得加入盐酸的质量与锥形瓶中物质的质量关系如图所示.