题目内容
 探究实验室中久置的NaOH的变质程度
探究实验室中久置的NaOH的变质程度【研究方案】先称取13.3g 的NaOH样品(杂质为Na2CO3),配成溶液,然后向溶液中逐滴加入质量分数为14.6%的稀盐酸,根据生成CO2的质量测定Na2CO3的质量.从而进一步确定样品中NaOH的变质程度.
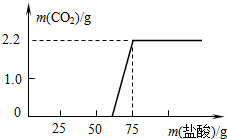
【解决问题】实验测得加入稀盐酸的质量与产生CO2气体的质量关系如图所示.
(1)算出样品中碳酸钠的质量
(2)样品中氢氧化钠的质量分数.
(3)求实验过程中与NaOH反应所用盐酸溶液的质量.
考点:根据化学反应方程式的计算
专题:综合计算(图像型、表格型、情景型计算题)
分析:在变质的氢氧化钠中滴加盐酸,盐酸与碳酸钠产生二氧化碳气体,根据二氧化碳气体的质量可确定碳酸钠的质量以及碳酸钠消耗盐酸的质量进行解答.
解答:解:(1)由图示可知产生的二氧化碳的质量为2.2g;
设生成2.2g二氧化碳时需要的碳酸钠质量是x,碳酸钠消耗盐酸的质量为y.
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73 44
x y×14.6% 2.2g
=
x=5.3g
=
y=25g
(2)样品中氢氧化钠的质量分数=
×100%=60.2%
(3)由图可知,氢氧化钠和碳酸钠消耗盐酸的总质量为75g,所以实验过程中与NaOH反应所用盐酸溶液的质量=75g-25g=50g
答:(1)样品中碳酸钠的质量为5.3g;
(2)样品中氢氧化钠的质量分数为60.2%;
(3)实验过程中与NaOH反应所用盐酸溶液的质量为50g.
设生成2.2g二氧化碳时需要的碳酸钠质量是x,碳酸钠消耗盐酸的质量为y.
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73 44
x y×14.6% 2.2g
| 106 |
| x |
| 44 |
| 2.2g |
x=5.3g
| 73 |
| y×14.6% |
| 44 |
| 2.2g |
y=25g
(2)样品中氢氧化钠的质量分数=
| 13.3g-5.3g |
| 13.3g |
(3)由图可知,氢氧化钠和碳酸钠消耗盐酸的总质量为75g,所以实验过程中与NaOH反应所用盐酸溶液的质量=75g-25g=50g
答:(1)样品中碳酸钠的质量为5.3g;
(2)样品中氢氧化钠的质量分数为60.2%;
(3)实验过程中与NaOH反应所用盐酸溶液的质量为50g.
点评:在碱和盐的混合溶液中滴加盐酸时,盐酸首先与碱反应,然后再跟盐反应,所以在氢氧化钠和碳酸钠的混合物中滴加盐酸,一开始没有二氧化碳产生.

练习册系列答案
相关题目




 称取NaCl和BaCl2的固体混合物32.5g,加入100g蒸馏水,完全溶解后向该混合溶液中逐滴加入Na2SO4溶液,反应生成BaSO4沉淀的质量与所加入的Na2SO4溶液的质量关系如图所示.试回答下列问题:
称取NaCl和BaCl2的固体混合物32.5g,加入100g蒸馏水,完全溶解后向该混合溶液中逐滴加入Na2SO4溶液,反应生成BaSO4沉淀的质量与所加入的Na2SO4溶液的质量关系如图所示.试回答下列问题: