题目内容
10.实验室有氯酸钾、二氧化锰、稀盐酸、石灰石、棉花及以下仪器:
(1)实验室制取并收集氧气所需要的仪器是①③⑤⑥⑦⑧(填序号).
(2)请写出实验室利用上述药品制取氧气的化学方程式:2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑.

(3)实验室制取二氧化碳气体,需用以上仪器中的②③④⑧(填序号).若将制取二氧化碳的发生装置与如图A装置连接:实验过程中A装置内的实验现象是燃着的蜡烛由下至上依次熄灭,若取来一朵用石蕊溶液染成的紫色干燥小花,将小花的一半用水喷湿,放入集气瓶中,如图B所示,可观察到的实验现象为用水喷湿一侧紫色石蕊小花变红.
(4)理论上制取4.4g的二氧化碳,需要纯度为80%的石灰石12.5g.
分析 (1)根据提供的药品以及制取和收集气体的仪器来分析解答;
(2)根据化学方程式的写法来分析;
(3)根据制取二氧化碳的方法以及二氧化碳的性质来分析;
(4)根据碳酸钙与盐酸反应的方程式,由二氧化碳的质量可以求出碳酸钙的质量.
解答 解:(1)根据提供的药品可知,该方法为加热氯酸钾与二氧化锰的混合物来制取氧气,属于固体加热型,所以需要用到试管、铁架台、带导管的单孔塞、酒精灯、水槽、集气瓶;故填:①③⑤⑥⑦⑧;
(2)氯酸钾在二氧化锰作催化剂加热的条件下分解为氯化钾和氧气;故填:2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑;
(3)实验室中通常大理石或石灰石与稀盐酸反应来制取二氧化碳,属于固液常温下制取气体,所以需要仪器锥形瓶、长颈漏斗、双孔塞、集气瓶;由于二氧化碳的密度大于空气的密度,且不支持燃烧,不燃烧,所以将二氧化碳通入如此装置时看到的现象为燃着的蜡烛由下至上依次熄灭;二氧化碳能与水反应生成碳酸,碳酸能使紫色的石蕊试液变红色,所以看到喷水的一侧纸花变成变成红色,另一侧不变色;故填:②③④⑧;燃着的蜡烛由下至上依次熄灭;用水喷湿一侧紫色石蕊小花变红;
(4)设需含碳酸钙质量分数为80%的石灰石的质量为x
CaCO3+2HCl═CaCl2+CO2↑+H2O
100 44
x×80% 4.4g
$\frac{100}{44}=\frac{x×80%}{4.4g}$
解得x=12.5g
故填:12.5.
点评 实验是化学的重要组成部分,正确的实验操作是得出科学结论的前提条件之一,因此要学会设计实验、进行实验、分析实验,为得出正确的结论奠定基础.

| A. |  给液体加热 | B. |  给固体加热 | ||
| C. |  用排空气法收集氧气 | D. |  加热氯酸钾制氧气 |
| A. | 使混合气体通过灼热的氧化铜 | B. | 使混合气体通过澄清石灰水 | ||
| C. | 使混合气体通过炙热的木炭层 | D. | 用燃着的木条将一氧化碳点燃烧掉 |
| A. | 金刚石和石墨化学性质不同,是由于碳原子的排列方式不同 | |
| B. | 人喝了雪碧后会打嗝,主要是由于H2CO3受热易分解生成CO2的缘故 | |
| C. | 二氧化碳中混有少量一氧化碳,可通过点燃的方法除去 | |
| D. | 二氧化碳可用于灭火,既利用了其物理性质,也利用了其化学性质 |

 ,则X的值为8;
,则X的值为8; 实验室欲测定一瓶标签破损的稀硫酸的溶质质量分数,现取10g稀硫酸样品,将8%的NaOH溶液逐滴加入到样品中,边加边搅拌,随着NaOH溶液的加入,溶液的pH的变化如图所示.(已知硫酸钠溶液为中性)
实验室欲测定一瓶标签破损的稀硫酸的溶质质量分数,现取10g稀硫酸样品,将8%的NaOH溶液逐滴加入到样品中,边加边搅拌,随着NaOH溶液的加入,溶液的pH的变化如图所示.(已知硫酸钠溶液为中性)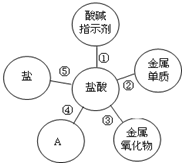 归纳是学习的重要方法,小红在复习盐酸的性质时归纳出盐酸的五条化学性质(如图所示,连线表示相互反应).
归纳是学习的重要方法,小红在复习盐酸的性质时归纳出盐酸的五条化学性质(如图所示,连线表示相互反应). 如图,为检查装置的气密性,将导管的末端伸入装有水的烧杯中,用手捧住试管,若装置的气密性良好,则烧杯内导管处的现象(画圈部分放大)是( )
如图,为检查装置的气密性,将导管的末端伸入装有水的烧杯中,用手捧住试管,若装置的气密性良好,则烧杯内导管处的现象(画圈部分放大)是( )


