题目内容
9.盐酸和氯化钡的混合溶液200g,其中盐酸的溶质质量分数为10%.向混合溶液中加入12%的硫酸溶液100g恰好完全反应.请计算:(1)生成沉淀的质量是多少克?
(2)反应后所得溶液中盐酸的质量分数.
分析 依据盐酸的溶质质量分数可以求出混合液中HCl的质量,利用加入硫酸溶液的质量是100g时氯化钡恰好和稀硫酸反应,则可求出生成沉淀和HCl的质量,据此对相关问题进行分析解答即可.
解答 解:设生成硫酸钡的质量是x,生成HCl的质量是y
BaCl2+H2SO4=BaSO4↓+2HCl
98 233 73
100g×12% x y
$\frac{98}{100g×12%}$=$\frac{233}{x}$=$\frac{73}{y}$
x=28.5g y=8.94g
(1)生成沉淀的质量是28.5克;
(2)反应后所得溶液中溶质的质量分数 $\frac{8.94g+200g×10%}{200g+100g-28.5g}$×100%=10.7%
答:(1)生成沉淀的质量是28.5g;(2)恰好完全反应时所得溶液中盐酸的质量分数为10.7%.
点评 此题是依据化学方程式计算的考查题,解题的关键是能够分析出物质间相关的反应以及化学方程式计算的相关基础.

练习册系列答案
相关题目
19.下列物质中,铁显+2价的是( )
| A. | Fe | B. | Fe2O3 | C. | FeCl3 | D. | FeSO4 |
7.下列各种物质可用于实验室制取氧气的是( )
| A. | 水 | B. | 氯酸钾 | C. | 空气 | D. | 氧化镁 |
8.下列变化中不属于化学变化的是( )
| A. | 爆竹爆炸 | B. | 纸张燃烧 | C. | 胆矾研碎 | D. | 菜刀生锈 |
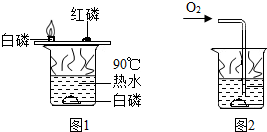 小明用图1所示装置探究可燃物燃烧的条件.他发现热水中的白磷熔化成一白色小液滴.不久,铜片的白磷开始燃烧,而红磷和水中的白磷都不燃烧.请回答:
小明用图1所示装置探究可燃物燃烧的条件.他发现热水中的白磷熔化成一白色小液滴.不久,铜片的白磷开始燃烧,而红磷和水中的白磷都不燃烧.请回答: