题目内容
2.一定条件下,5.6gC2H4与17.6gO2恰好完全反应,生成7.2gH2O、13.2gCO2和物质X.则X的质量为2.8g,该反应中C2H4与X的化学计量数之比为2:1.分析 根据反应前后质量总和不变列等式计算出X的值;根据质量比结合相对分子质量进行分析.
解答 解:根据质量守恒定律,反应前后质量总和不变列等式:5.6g+17.6g=7.2g+13.2g+X,解得X=2.8g;
根据质量守恒定律,反应前后元素的种类不变,C2H4不完全燃烧时会产生一氧化碳,所以X是一氧化碳,C2H4、氧气、二氧化碳、水、一氧化碳的分子个数比为:$\frac{5.6g}{28}:\frac{17.6g}{32}:\frac{13.2g}{44}:\frac{7.2g}{18}:\frac{2.8g}{28}$=4:11:6:8:2;将苯燃烧的方程式配平得:4C2H4+11O2$\frac{\underline{\;点燃\;}}{\;}$6CO2+8H2O+2CO,该反应方程式中C2H4与X化学计量数之比为:2:1;
答案:2.8g;2:1.
点评 解答本题关键是要熟悉质量守恒定律的内容,并能灵活运用解决实际问题.

练习册系列答案
相关题目
12.下列说法错误的是( )
| A. | 可以通过降低着火点的方法来灭火 | |
| B. | 玻璃属于无机非金属材料 | |
| C. | 使用可降解塑料可缓解白色污染 | |
| D. | 电解水实验中正负极产生的气体体积比为1:2 |
10.为相对原子质量的测定作出卓越贡献,主持测定了铟、铱等相对原子质量新值的科学家是( )
| A. |  侯德榜 | B. |  拉瓦锡 | C. |  门捷列夫 | D. |  张青莲 |
17.下列各组离子能在pH=1的水溶液中大量共存且形成无色溶液的是( )
| A. | NH4+、NO3-、Na+、Cl- | B. | CO32-、K+、Na+、Cl- | ||
| C. | Cu2+、OH-、SO42-、Ba2+ | D. | Ag+、Cl-、Fe2+、NO3- |
7.下列图象中有关量的变化趋势与对应叙述关系正确的是( )
| A. | 分别向盛有等质量铝粉和镁粉的两个烧杯中,不断滴加等浓度的稀硫酸.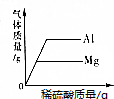 | |
| B. | 在密闭容器中点燃一定量的氢气和氧气的混合气体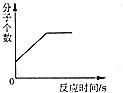 | |
| C. | 向硝酸银、硝酸铜混合溶液中加入一定量的锌粉,充分反应后过滤,得到无色液体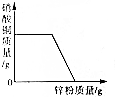 | |
| D. | 向一定量的稀盐酸中不断加入石灰石粉末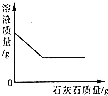 |
14.分析推理是化学学习过程中的常用方法,下列推理正确的是( )
| A. | 化合物含有不同元素的纯净物,所以含有不同种元素的纯净物一定是化合物 | |
| B. | 分子、原子可以构成物质,所以物质一定是由分子、原子构成的 | |
| C. | 可燃物燃烧时温度需要达到着火点,所以可燃物的温度达到着火点一定能燃烧 | |
| D. | 物质和氧气发生的反应是氧化反应,所以发生氧化反应一定有氧气参加 |
11.人体中发生的以下变化属于物理变化的是( )
| A. | 汗水的挥发 | B. | 蛋白质的水解 | C. | 葡萄糖的氧化 | D. | 油脂的消化吸收 |
12. 甲、乙两种固体物质的溶解度曲线如图所示.下列叙述中正确的是( )
甲、乙两种固体物质的溶解度曲线如图所示.下列叙述中正确的是( )
 甲、乙两种固体物质的溶解度曲线如图所示.下列叙述中正确的是( )
甲、乙两种固体物质的溶解度曲线如图所示.下列叙述中正确的是( )| A. | 甲物质的溶解度大于乙物质的溶解度 | |
| B. | t1℃时,甲、乙两物质饱和溶液的溶质质量分数一定相等 | |
| C. | t2℃时,将30g甲物质放入70g水中,所得饱和溶液的质量为100g | |
| D. | t2℃时,甲、乙两物质的饱和溶液降温到t1℃,析出晶体质量甲>乙 |