题目内容
13.酸、碱、盐是中学化学学习和研究的重要内容(1)热水瓶永久后,瓶胆内壁常附着一层水垢[主要成分是CaCO3和Mg(OH)2]可用稀盐酸除掉,写出稀盐酸与CaCO3反应的化学方程式CaCO3+2HCl═CaCl2+H2O+CO2↑.
(2)采用氨碱法生产纯碱,主要流程如图:
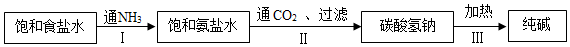
①上述Ⅰ、Ⅱ两个步骤总反应的化学方程式是NH3+CO2+H2O+NaCl═NaHCO3+NH4Cl.
②从步骤Ⅱ过滤后的滤液中可获得铵态氮肥.检验铵态氮肥的方法是取少量样品于试管中,加氢氧化钠溶液混合加热能放出气体,在试管口放一湿润的红色石蕊试纸,如果试纸变蓝,说明是氨态氮肥.
(3)蒸发海水得到的粗盐中除含NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质,以下是将粗盐进行提纯的实验步骤.
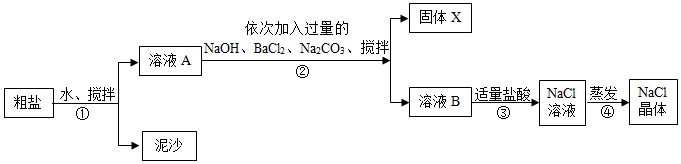
①加入过量Na2CO3溶液的目的是除去氯化钙和过量的氯化钡,溶液B中含有的溶质有氯化钠、氢氧化钠、碳酸钠,步骤④用到玻璃棒的作用是引流.
②固体X的成分是CaCO3、BaCO3、BaSO4和Mg(OH)2,请写出生成Mg(OH)2的化学方程式MgCl2+2NaOH═Mg(OH)2↓+2NaCl.
(4)在13.6g含氯化钠杂质的纯碱样品中逐步加入质量分数为7.3%稀盐酸,当加入100g稀盐酸时,所得溶液的pH为7.求样品中纯碱的质量分数是多少?(结果保留整数)
分析 (1)首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤进行书写即可.
(2)①根据氨碱法生产纯碱的反应原理书写化学方程式,注意条件和配平;
②铵态氮肥与碱混合加热时能放出氨气,氨气能使湿润的红色石蕊试纸变蓝.
(3)加入过量的氢氧化钠溶液可以除去氯化镁,加入过量的氯化钡溶液可以除去硫酸钠,加入过量的碳酸钠溶液可以除去氯化钙和过量的氯化钡;
(4)碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳,根据反应的化学方程式和提供的数据可以进行相关方面的计算.
解答 解:(1)碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑.
(2)①氨碱法生产纯碱的化学反应原理是用氨气和二氧化碳与氯化钠和水反应生成碳酸氢钠,化学方程式:NH3+CO2+H2O+NaCl═NaHCO3+NH4Cl;
②铵态氮肥与氢氧化钠溶液混合加热时能放出气体,这种气体能使湿润的红色石蕊试纸变蓝,证明铵态氮肥;故填:取少量样品于试管中,加氢氧化钠溶液混合加热能放出气体,在试管口放一湿润的红色石蕊试纸,如果试纸变蓝,说明是氨态氮肥.
(3)①加入过量Na2CO3溶液可以除去氯化钙和过量的氯化钡;加入过量的氢氧化钠溶液可以除去氯化镁,加入过量的氯化钡溶液可以除去硫酸钠,加入过量的碳酸钠溶液可以除去氯化钙和过量的氯化钡;所以溶液B中含有的溶质有氯化钠、氢氧化钠、碳酸钠;过滤过程中玻璃棒的作用是引流;
②氯化镁与氢氧化钠反应生成氢氧化镁沉淀和氯化钠,化学方程式为:MgCl2+2NaOH═Mg(OH)2↓+2NaCl;故填:除去氯化钙和过量的氯化钡;氯化钠、氢氧化钠、碳酸钠;引流;MgCl2+2NaOH═Mg(OH)2↓+2NaCl;
(4)100g稀盐酸中氯化氢的质量为:100g×7.3%=7.3g.
设碳酸钠质量为x
Na2CO3+2HCl═2NaCl+H2O+CO2↑,
106 73
x 7.3g
$\frac{106}{x}=\frac{73}{7.3g}$
x=10.6g
纯碱样品中碳酸钠的质量分数:$\frac{10.6g}{13.6g}×100%$=78%.
答:纯碱样品中碳酸钠的质量分数为78%.
点评 本题主要考查了选择试剂、化学方程式的书写、化学方程式的计算,以此培养学生的理解能力、培养学生分析问题、解决问题的能力.

| A. | 油锅着火可立即盖上锅盖灭火 | |
| B. | 用扇子扇风熄灭蜡烛是因为隔绝了氧气 | |
| C. | 将煤粉制成蜂窝煤,能增大与空气的接触面积 | |
| D. | 物质燃烧的剧烈程度与氧气的浓度有关 |