题目内容
8.某纯碱样品中含有少量氯化钠.为测定该纯碱的纯度(即碳酸钠的质量分数),设计了如下实验:【设计实验方案】实验装置 (如图所示,固定装置略去):
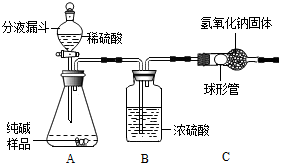
需要测定的实验数据:纯碱样品的质量;实验前后两次测定C装置(包含NaOH固体)的质量.
其目的是计算反应生成二氧化碳的质量,进一步计算碳酸钠的纯度.
(1)A装置中反应化学方程式是Na2CO3+H2SO4═Na2SO4+H2O+CO2↑.
判断样品中的碳酸钠已完全反应的方法是不再产生气泡.
(2)B装置的作用是吸收二氧化碳中的水蒸气;
C装置中的化学方程式是2NaOH+CO2═Na2CO3+H2O;
【交流与表达】
(3)其中会导致纯碱的纯度偏高的是②(填序号).
①A、B装置中残留的CO2 气体未被装置C中的NaOH 吸收
②C装置中的氢氧化钠固体吸收了装置外空气中的水分和二氧化碳
【反思与评价】
(4)不能用浓盐酸代替稀硫酸理由是浓盐酸易挥发.
(5)若测定纯碱样品的质量为W g,第一次测定C装置的质量为M g,第二次测定C装置的质量为N g,则该实验测定纯碱样品中纯碱的纯度为$\frac{10600(N-M)}{44W}$%.(用字母表示)
分析 【设计实验方案】实验前后两次测定C装置(包含NaOH固体)的质量,质量差是碳酸钠和稀硫酸反应生成二氧化碳的质量;
(1)碳酸钠和稀硫酸反应生成硫酸钠、水和二氧化碳;
(2)B装置的作用是吸收水蒸气;
氢氧化钠和二氧化碳反应生成碳酸钠和水;
(3)①A、B装置中残留的CO2 气体未被装置C中的NaOH吸收时,会导致测定的碳酸钠质量分数偏低;
②C装置中的氢氧化钠固体吸收了装置外空气中的水分和二氧化碳,会导致测定的碳酸钠质量分数偏高;
(4)不能否用浓盐酸代替稀硫酸理由是浓盐酸易挥发;
(5)根据反应的化学方程式及其提供的数据可以进行相关方面的计算.
解答 解:【设计实验方案】需要测定的实验数据:纯碱样品的质量;实验前后两次测定C装置(包含NaOH固体)的质量,其目的是计算反应生成二氧化碳的质量,进一步计算碳酸钠的纯度.
故填:计算反应生成二氧化碳的质量,进一步计算碳酸钠的纯度.
(1)A装置中碳酸钠和稀硫酸反应生成硫酸钠、水和二氧化碳,反应化学方程式是:Na2CO3+H2SO4═Na2SO4+H2O+CO2↑;
判断样品中的碳酸钠已完全反应的方法是不再产生气泡.
故填:Na2CO3+H2SO4═Na2SO4+H2O+CO2↑;不再产生气泡.
(2)B装置的作用是吸收二氧化碳中的水蒸气;
C装置中氢氧化钠和二氧化碳反应生成碳酸钠和水,反应的化学方程式是:2NaOH+CO2═Na2CO3+H2O.
故填:吸收二氧化碳中的水蒸气; 2NaOH+CO2═Na2CO3+H2O.
(3)①A、B装置中残留的CO2 气体未被装置C中的NaOH吸收时,会导致测定的碳酸钠质量分数偏低;
②C装置中的氢氧化钠固体吸收了装置外空气中的水分和二氧化碳,会导致测定的碳酸钠质量分数偏高.
故选:②.
(4)不能否用浓盐酸代替稀硫酸理由是浓盐酸易挥发,挥发出的氯化氢能被氢氧化钠吸收,导致测定结果偏大.
故填:浓盐酸易挥发.
(5)设样品中碳酸钠质量为x,
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑,
106 44
x (N-M)g
$\frac{106}{x}$=$\frac{44}{(N-M)g}$,
x=$\frac{106}{44}$ (N-M)g,
则该实验测定纯碱样品中纯碱的纯度为:$\frac{106(N-M)g}{44Wg}$×100%=$\frac{10600(N-M)}{44W}$%,
故填:$\frac{10600(N-M)}{44W}$%.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

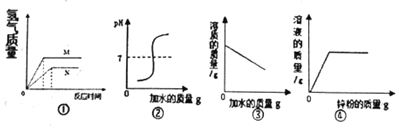
| A. | 图①金属的活泼性M>N | |
| B. | 图②是向硫酸溶液中加水,溶液pH的变化 | |
| C. | 图③是向饱和食盐水中不断加水 | |
| D. | 图④是向一定质量硫酸铜溶液中不断加入锌粉 |
| A. | BaSO4(BaCO3) 加足量稀盐酸、过滤、洗涤、干燥 | |
| B. | KCl(K2CO3) 加足量稀盐酸、过滤、蒸发、结晶 | |
| C. | CuO( Fe ) 加足量稀盐酸、过滤、洗涤、干燥 | |
| D. | MnO2( KCl ) 加水溶解、过滤、蒸发、结晶 |
| A. | 该反应涉及的物质都是由原子构成的 | |
| B. | FeCl3中铁元素、氯元素的质量比为1:3 | |
| C. | X的化学式为FeCl2 | |
| D. | Fe中铁元素的化合价为+3 |
| A. | N2:表示1个氮气分子中有2个氮原子 | |
| B. | $\stackrel{+2}{Mg}$O:表示氧化镁中镁原子的化合价为+2价 | |
| C. | 2He:表示2个氦原子 | |
| D. | SO42-:表示一个硫酸根离子带2个单位负电荷 |
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向醋酸中加入氢氧化钠溶液 | 无明显现象 | 二者之间不发生反应 |
| B | 向溶质质量分数为5%的过氧化氢溶液中加少量氧化铜 | 有大量气泡产生 | 氧化铜起催化作用 |
| C | 将两根铁丝分别伸入硫酸铜溶液和硝酸银溶液中 | 两根铁丝上均有固体附着 | 金属的活动性顺序为Fe>Cu>Ag |
| D | 用导管分别对准浸没在热水和冷水中的白磷通气 | 热水中的白磷燃烧,冷水中的白磷不燃烧 | 燃烧的条件之一是温度达到着火点 |
| A. | A | B. | B | C. | C | D. | D |




 近年来,我国的高铁建设得到了飞速发展,从整车进口到技术引进,再到自主生产,动车组列车已经完全国产化,并且引领国际潮流,“高铁外交”作为国家新名片,开启中国外交的3.0时代.高铁铁轨采用长距离无缝钢轨,用得较多的是高碳微锰钢.请回答:
近年来,我国的高铁建设得到了飞速发展,从整车进口到技术引进,再到自主生产,动车组列车已经完全国产化,并且引领国际潮流,“高铁外交”作为国家新名片,开启中国外交的3.0时代.高铁铁轨采用长距离无缝钢轨,用得较多的是高碳微锰钢.请回答: