题目内容
1.有一包白色粉末,可能由Ca(OH)2,Na2CO3,BaCl2,Na2SO4,NaOH,CuSO4中的一种和几种组成,为了探究固体的成分,现做如下实验: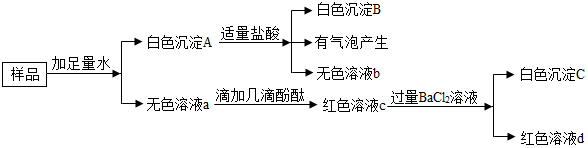
(1)原固体中一定没有CuSO4;
(2)原固体中一定有Na2CO3,BaCl2,Na2SO4;
(3)生成气体的化学方程式BaCO3+2HCl=BaCl2+H2O+CO2↑;;
(4)无色溶液a中一定含有的溶质NaCl;
(5)下列关于溶液和白色沉淀的设想,合理的是C.
A.除去硝酸钡中的硝酸:用白色沉淀A B.无色溶液a能除去氯化钠中少量的盐酸
C.鉴别盐酸和碳酸钠:用溶液b、c、d.
分析 根据题干提供的信息进行分析解答,样品加水得无色溶液,故一定不含有硫酸铜;白色沉淀加盐酸能产生气泡,故一定有碳酸钡沉淀,故白色固体中一定含有碳酸钠和氯化钡,加盐酸仍然含有白色沉淀,故沉淀一定有硫酸钡,故固体中一定含有硫酸钠;无色溶液加酚酞变红,说明含有碱性物质,加氯化钡能产生白色沉淀,且溶液仍为红色,说明含有氢氧化钠,据此解答.
解答 解:样品加水得无色溶液,故一定不含有硫酸铜;白色沉淀加盐酸能产生气泡,故一定有碳酸钡沉淀,故白色固体中一定含有碳酸钠和氯化钡,加盐酸仍然含有白色沉淀,故沉淀一定有硫酸钡,故固体中一定含有硫酸钠;无色溶液加酚酞变红,说明含有碱性物质,加氯化钡能产生白色沉淀,且溶液仍为红色,说明含有氢氧化钠;(1)根据推断,原固体中一定不含有硫酸铜,故填:CuSO4;
(2)根据推断,原固体中一定有 Na2CO3,BaCl2,Na2SO4;
(3)生成气体的化学方程式为BaCO3+2HCl=BaCl2+H2O+CO2↑;
(4)因为Na2CO3与BaCl2反应生成氯化钠和碳酸钡沉淀,无色溶液a中一定含有的溶质 NaCl;
(5)A.除去硝酸钡溶液中的硝酸:加入过量的白色沉淀A,则碳酸钡沉淀遇硝酸反应生成硝酸钡,正确;
B.除去氯化钠溶液中少量的盐酸:加入适量的无色溶液a,则含有氯化钡,错误;
C.鉴别稀盐酸和碳酸钠溶液:用溶液b、c、d,b这中含有氯化钡,能与碳酸钠反应产生白色沉淀,而盐酸与氯化钡不反应,可以鉴别.
故选AC.
故答案为:
(1)CuSO4; (2)Na2CO3,BaCl2,Na2SO4;(3)BaCO3+2HCl=BaCl2+H2O+CO2↑; (4)NaCl;(5)C.
点评 本题为框图式物质推断题,完成此题,关键是根据题干叙述,找准解题的突破口,直接得出有关物质的化学式,然后根据物质的性质结合框图得出其他物质的化学式.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 中和反应有盐和水生成,所以有盐和水生成的化学反应一定是中和反应 | |
| B. | 单质只含一种元素,所以含一种元素的物质一定是单质 | |
| C. | 复分解反应前后,组成各物质的所有元素的化合价一定不变 | |
| D. | 氧化物中含有氧元素,含有氧元素的化合物一定是氧化物 |
| A. | X的化学式为H2 | |
| B. | 铝的化合价由0升至+3 | |
| C. | 该反应类型属于复分解反应 | |
| D. | 可采用与制取CO2相同的发生装置制取X |
| A. | 木炭在氧气中燃烧,发出白光,放出热量,产生二氧化碳气体 | |
| B. | 铁丝在氧气中剧烈燃烧,火星四溅,放出热量,生成红色粉末 | |
| C. | 镁条在空气中燃烧,冒出少量的白烟,放出热量,生成白色固体 | |
| D. | 硫在氧气中燃烧,发出微弱的淡蓝色火焰,放出热量,产生无色无味的气体 |


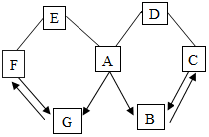 如图所示A~G是初中化学中常见的物质.图中“→”表示转化关系,“-”表示相互能反应.已知A时人体胃液中含有的酸,G是最轻的气体,B、C、D、E、F都是氧化物,D为红色粉末.请回答:
如图所示A~G是初中化学中常见的物质.图中“→”表示转化关系,“-”表示相互能反应.已知A时人体胃液中含有的酸,G是最轻的气体,B、C、D、E、F都是氧化物,D为红色粉末.请回答: