题目内容
9.下列说法中正确的是( )| A. | 中和反应有盐和水生成,所以有盐和水生成的化学反应一定是中和反应 | |
| B. | 单质只含一种元素,所以含一种元素的物质一定是单质 | |
| C. | 复分解反应前后,组成各物质的所有元素的化合价一定不变 | |
| D. | 氧化物中含有氧元素,含有氧元素的化合物一定是氧化物 |
分析 A、根据二氧化碳和氢氧化钠会生成碳酸钠和水,不属于中和反应进行分析;
B、根据单质的概念进行分析;
C、根据复分解反应前后,组成各物质的所有元素的化合价一定不变进行分析;
D、根据氧化物的定义判断.
解答 解:A、有盐和水生成的化学反应不一定是中和反应,例如二氧化碳和氢氧化钠会生成碳酸钠和水,不属于中和反应,故错误.
B、含有一种元素的物质不一定是单质,例如氧气和臭氧组成的物质,故错误;
C、复分解反应只是相互交换成分,反应前后,组成各物质的所有元素的化合价一定不变,故正确;
D、由氧化物的定义知含有氧元素的化合物不一定是氧化物,如KClO3,故错误;
故选:C.
点评 此题主要考查中和反应、单质、复分解反应以及氧化物的概念理解等方面的知识,考查面广,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.下列实验基本操作正确的是( )
| A. |  稀释浓硫酸 | B. |  蒸发食盐水 | C. |  测定溶液PH值 | D. |  加热试管内液体 |
4.规范的操作是实验成功的前提.下列实验操作不正确的是( )
| A. | 将实验过程中剩余的试剂丢弃是浪费行为.所以,实验结束后,都应回收并放回原试剂瓶 | |
| B. | 为了防止液体滴到试管外部,滴管应伸入试管内小心滴加液体 | |
| C. | 用干燥pH试纸来测定溶液的酸碱度 | |
| D. | 没有腐蚀性的药品可直接放在托盘上称量,有腐蚀性的应放在烧杯中称量 | |
| E. | 取用液体药品时,要把瓶塞倒放在桌面上,标签朝向手心,放回原处时标签向外 | |
| F. | 用试管夹夹持试管给液体加热时,不要把拇指按在试管夹短柄上,试管口不能对着自己,试管内液体不超过试管容积的一半 |
14.下列知识整理的内容不完全正确的一组是( )
| A.化学常识 | B.化学与安全 |
| 空气的主要成分--氮气和氧气 硬水和软水--用肥皂水来检验 | 居室装修--常开窗通风,使有害物挥发 煤气泄漏--关闭气阀、打开排气扇电源开关 |
| C.化学与材料 | D.化学与环境 |
| 不锈钢汤勺--合金 聚乙烯塑料--有机合成材料 | 减少水污染--合理使用农药化肥 减少酸雨的发生--使用新型能源 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
3.氧化镁在医药、建筑等行业应用广泛,以菱镁矿(主要成分为MgCO3,含少量FeCO3,其他杂质不溶,也不参加反应)为原料制备高纯氧化镁的实验流程如下:

资料:①不同氢氧化物沉淀的pH范围:
②硫在常温下是一种淡黄色固体,硫的熔点约为115.2℃,沸点约为444.7℃;
③高锰酸钾溶液只吸收SO2,不吸收CO2;
④碱溶液既吸收SO2,又吸收CO2. 试回答下列问题:
(1)MgCO3与稀硫酸反应的化学方程式为MgCO3+H2SO4═MgSO4+H2O+CO2↑.
(2)加入H2O2目的是在酸性条件下将FeSO4氧化成Fe2(SO4)3,同时生成水,发生反应的化学方程式为2FeSO4+H2O2+H2SO4=Fe2(SO4)3+2H2O.
(3)加氨水调节溶液的pH约为4的目的是使铁离子完全转化成氢氧化铁沉淀,反应的化学方程式为Fe2(SO4)3+6NH3•H2O=3(NH4)2SO4+2Fe(OH)3↓.
800℃
(4)煅烧过程存在以下反应:
2MgSO4+C$\frac{\underline{\;800℃\;}}{\;}$2MgO+2SO2↑+CO2↑
MgSO4+C$\frac{\underline{\;800℃\;}}{\;}$MgO+SO2↑+CO↑
MgSO4+3C$\frac{\underline{\;800℃\;}}{\;}$MgO+S↑+3CO↑
利用如图装置对煅烧产生的气体进行分步吸收或收集.(假设每步反应都完全进行)
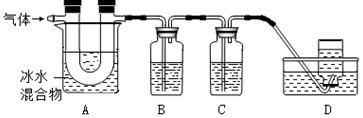
①A中现象是:玻璃管壁出现淡黄色固体;
②B中盛放的溶液可以是a(填字母),实验现象为产生沉淀;
a.Ca(OH)2 溶液 b.Na2CO3 溶液 c.稀硝酸 d.KMnO4溶液
③D中收集的气体是CO(填化学式).

资料:①不同氢氧化物沉淀的pH范围:
| 氢氧化物 | Fe(OH)3 | Mg(OH)2 |
| 开始沉淀的pH | 1.5 | 8.6 |
| 完全沉淀的pH | 3.2 | 11.1 |
③高锰酸钾溶液只吸收SO2,不吸收CO2;
④碱溶液既吸收SO2,又吸收CO2. 试回答下列问题:
(1)MgCO3与稀硫酸反应的化学方程式为MgCO3+H2SO4═MgSO4+H2O+CO2↑.
(2)加入H2O2目的是在酸性条件下将FeSO4氧化成Fe2(SO4)3,同时生成水,发生反应的化学方程式为2FeSO4+H2O2+H2SO4=Fe2(SO4)3+2H2O.
(3)加氨水调节溶液的pH约为4的目的是使铁离子完全转化成氢氧化铁沉淀,反应的化学方程式为Fe2(SO4)3+6NH3•H2O=3(NH4)2SO4+2Fe(OH)3↓.
800℃
(4)煅烧过程存在以下反应:
2MgSO4+C$\frac{\underline{\;800℃\;}}{\;}$2MgO+2SO2↑+CO2↑
MgSO4+C$\frac{\underline{\;800℃\;}}{\;}$MgO+SO2↑+CO↑
MgSO4+3C$\frac{\underline{\;800℃\;}}{\;}$MgO+S↑+3CO↑
利用如图装置对煅烧产生的气体进行分步吸收或收集.(假设每步反应都完全进行)

①A中现象是:玻璃管壁出现淡黄色固体;
②B中盛放的溶液可以是a(填字母),实验现象为产生沉淀;
a.Ca(OH)2 溶液 b.Na2CO3 溶液 c.稀硝酸 d.KMnO4溶液
③D中收集的气体是CO(填化学式).

 水是人们生活生产中应用最多的物质:
水是人们生活生产中应用最多的物质: