题目内容
6.(1)如图1有A、B、C三个实验操作图,回答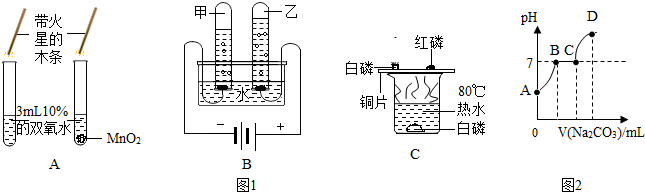
①实验A现象是加入二氧化锰有大量气泡产生,木条复燃;
②实验B水中加入少量氢氧化钠,导电性明显增加原因是氢氧化钠溶于水,能产生自由移动的钠离子和氯离子;
③实验C,使用红磷的作用是和白磷比较,得出可燃物燃烧条件之一是温度达到着火点.
(2)某兴趣小组在实验室中制取CO2气体后,对废液进行后续探究,向一定量的废液中逐滴加入Na2CO3溶液,加入Na2CO3溶液的体积与溶液pH变化如2图所示,填空:
①AB段反应的现象是有气体产生;
②BC段发生反应的化学方程式为Na2CO3+CaCl2═CaCO3↓+2NaCl;
③D点表示溶液中溶质有NaCl、Na2CO3(填化学式);
④为了防止污染,兴趣小组对废液进行处理,在不用指示剂的情况下,加入下列过量的物质使废液呈中性,该物质可能是C.
A.生石灰 B.熟石灰 C.石灰石 D.纯碱
(3)有密封不好的氢氧化钠样品,取l0g白色粉未加入足量水充分溶解,再滴加足量的澄清石灰水,充分反应后过滤,得到白色沉淀8克,请计算白色粉未中氢氧化钠的质量分数.
分析 (1)①根据二氧化锰是过氧化氢制氧气中反应的催化剂解答;
②根据氢氧化钠溶于水,能产生自由移动的钠离子和氯离子解答;
③根据使用红磷的作用是对比解答;
(2)根据加入的碳酸钠先与盐酸反应,把盐酸消耗完了,才开始与氯化钙反应,开始生成沉淀,最后到达最高点说明已经反应完了进行解答.
(3)根据氢氧化钠吸收空气中二氧化碳形成碳酸钠,部分变质的氢氧化钠为氢氧化钠和碳酸钠和水形成的混合物,利用碳酸钠与氢氧化钙反应的化学方程式,由生成沉淀碳酸钙的质量计算样品中碳酸钠的质量,从而求出氢氧化钠的质量,该质量与样品的质量比可计算样品中氢氧化钠的质量分数.
解答 解:(1)①二氧化锰是过氧化氢制氧气中反应的催化剂,实验A现象是加入二氧化锰有大量气泡产生,木条复燃;
②氢氧化钠溶于水,能产生自由移动的钠离子和氯离子,可以增强水的导电性;
③实验C,使用红磷的作用是和白磷比较,得出可燃物燃烧条件之一是温度达到着火点;
(2)①由图2可知,加入的碳酸钠先与盐酸反应,把盐酸消耗完,才开始与氯化钙反应,开始生成沉淀,AB段是碳酸钠和盐酸反应,生成氯化钠、水和二氧化碳气体,反应的现象是有气体产生;
②BC段反应过程中是碳酸钠溶液和氯化钙反应,生成沉淀,溶液中性,发生反应的化学方程式为:Na2CO3+CaCl2═CaCO3↓+2NaCl;
③D点表示反应完毕,溶液呈碱性,溶液中溶质有NaCl和Na2CO3;
④使CaCl2与盐酸的混合溶液中和至中性,与盐酸反应,且不能引入新的杂质
A、生石灰可与盐酸反应,且不引入新杂质,但CaO过量时溶液显碱性,故错误;
B、熟石灰可与盐酸反应,且不引入新杂质,但熟石灰过量时溶液显碱性,故错误;
C、石灰石可与盐酸反应,且不引入新杂质,石灰石不溶于水,所以至中性时最好选择石灰石,故正确;
D、碳酸钠与盐酸反应生成氯化钠,反应引入新杂质,故错误.
(3)解:氢氧化钠吸收空气中二氧化碳形成碳酸钠,部分变质的氢氧化钠为氢氧化钠和碳酸钠和水形成的混合物,
设碳酸钠的质量为x
Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
106 100
x 8g
$\frac{106}{x}=\frac{100}{8g}$
x=8.48g
该样品中氢氧化钠的质量分数为:$\frac{10g-8.48g}{10}$×100%=15.2%
答案:
(1)①加入二氧化锰有大量气泡产生,木条复燃;
②氢氧化钠溶于水,能产生自由移动的钠离子和氯离子;
③和白磷比较,得出可燃物燃烧条件之一是温度达到着火点;
(2)①有气体产生;
②Na2CO3+CaCl2═CaCO3↓+2NaCl;
③NaCl、Na2CO3;
④C;
(3)该样品中氢氧化钠的质量分数为15.2%.
点评 根据反应的化学方程式可以表示反应中各物质的质量关系,由反应中某物质的质量可计算反应中其它物质的质量.

 阅读快车系列答案
阅读快车系列答案| 选项 | 实验目的 | 实验操作 |
| A | 除去氯化铁溶液中的盐酸 | 加足量的氧化铁固体,充分反应后过滤 |
| B | 鉴别氯化钠溶液和稀盐酸 | 滴加无色酚酞试液 |
| C | 分离铁粉和铜粉的混合物 | 加足量稀硫酸、充分反应后过程 |
| D | 检验氢氧化钠溶液是否完全变质 | 加氢氧化钙溶液 |
| A. | A | B. | B | C. | C | D. | D |
| A. | H2SO4 | B. | Na2S | C. | K2SO4 | D. | SO2 |
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
| 溶解度/g | 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
| 硝酸钾 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
| A. | 氯化钠和硝酸钾的溶解度曲线在20℃~30℃温度范围内会相交 | |
| B. | 在20℃时,向68g饱和氯化钠溶液中加入32g水,此时溶液中溶质的质量分数为18% | |
| C. | 分别将20℃时的饱和氯化钠溶液、饱和硝酸钾溶液升温至40℃,此时硝酸钾溶液中 溶质的质量分数大于氯化钠溶液 | |
| D. | 从含有少量硝酸钾的饱和氯化钠溶液中得到较多的氯化钠晶体,通常可采用蒸发溶剂使其结晶的方法 |
【提出问题】铁能与浓硫酸反应吗?
【查阅资料】浓硫酸具有强氧化性,铁、铝和浓硫酸在常温下接触时,浓硫酸会在铁、铝的表面反应形成一层致密的氧化物保护膜,防止浓硫酸继续和铁、铝反应.
【收集证据】
(1)铁能与稀盐酸、稀硫酸反应.铁与稀硫酸反应的化学方程式为Fe+H2SO4═FeSO4+H2↑.
(2)铁能与硫酸铜溶液反应,该反应的类型是置换反应.
【设计实验】下面是小亮设计的实验方案,请完成下表.
| 实验步骤 | 实验现象 |
| ①将一打磨过的铁片放入稀硫酸中 | 铁片表面有气泡产生,得到浅绿色溶液 |
| ②另取一打磨过的铁丝先放入浓硫酸中,一段时间后将铁丝取出,用水冲洗干净后,放入稀硫酸中,观察现象. | 铁丝在稀硫酸中刚开始没有明显现象,过一段时间铁丝表面有气泡产生. |
(2)步骤①的作用是作对比实验.
(3)由上述实验能(填“能”或“不能”)得出铁与浓硫酸发生了化学反应的结论.
【深入探究】改变上述实验中的步骤②也能得到相同的实验结论.请设计不同的实验方案,并将你的实验方案填入下表:(如果你的答案正确,你将得到4分奖励,但本卷满分不超过60分)
| 实验步骤 | 实验现象 |
| 另取一打磨过的铁丝先放入浓硫酸中,一段时间后将铁丝取出,用水冲洗干净后,放入硫酸铜溶液中,观察现象. | 无明显现象 |