题目内容
9.在初中化学中,我们学习了溶液的有关知识.图1是KNO3的溶解度曲线.
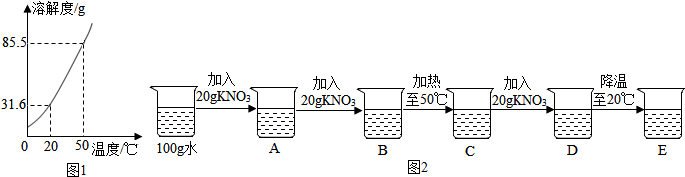
(1)从图1溶解度曲线可以得到的信息是(任写一条)20℃时,KNO3的溶解度是31.6g(合理即可).
(2)小明参照图2在20℃时进行了如下实验:
小明观察到A中所加固体全部溶解,则B中的现象是固体部分溶解.上述实验过程中属于不饱和溶液的是ACD.D中溶液的溶质质量分数是37.5%.
分析 (1)溶解度曲线可以表示该物质在某温度下的溶解度,表示溶解度受温度影响情况;
(2)溶解度是指一定温度下,100g水所能溶解溶质的最大质量;根据物质的溶解度,可以判断一定量溶剂溶解溶质后所得溶液的饱和状态,并进而计算溶液中溶质的质量分数.
解答 解:(1)根据溶解度曲线可查找任意温度下KNO3的溶解度,如20℃时KNO3的溶解度是31.6g;还可以表示物质溶解度受温度的影响,如KNO3的溶解度随温度升高而增大;
(2)根据溶解度曲线可知,20℃时KNO3的溶解度是31.6g,50℃时KNO3的溶解度是85.5g;
A烧杯内为20℃时100g水中加入20gKNO3固体,根据20℃时KNO3的溶解度是31.6g,可判断此时固体KNO3全部溶解,所得溶液为不饱和溶液;
B烧杯内为20℃时100g水中加入40gKNO3固体,根据20℃时KNO3的溶解度是31.6g,可判断此时固体KNO3不能全部溶解,因此,可观察到固体部分溶解,所得溶液为饱和溶液;
C烧杯内为50℃时100g水中加入40gKNO3固体,根据50℃时KNO3的溶解度是85.5g,可判断此时固体KNO3全部溶解,所得溶液为不饱和溶液;
D烧杯为50℃时100g水中加入60gKNO3固体,根据50℃时KNO3的溶解度是85.5g,可判断此时固体KNO3全部溶解,所得溶液为不饱和溶液;
E烧杯为20℃时100g水中加入60gKNO3固体,根据20℃时KNO3的溶解度是31.6g,可判断此时固体KNO3不能全部溶解,所得溶液为饱和溶液;
D烧杯为50℃时100g水中加入60gKNO3固体,此时固体KNO3全部溶解,所得溶液的溶质质量分数=$\frac{60g}{100g+60g}$×100%=37.5%
故答案为:(1)20℃时,KNO3的溶解度是31.6g(合理即可);
(2)固体部分溶解;ACD; 37.5%.
点评 本考点考查了溶解度曲线及其应用,通过溶解度曲线我们可以获得很多信息;还考查了有关溶液和溶质质量分数的计算,从而培养学生分析问题、解决问题的能力.

| A. | ①④ | B. | ①②④ | C. | ②③ | D. | ①②③④ |

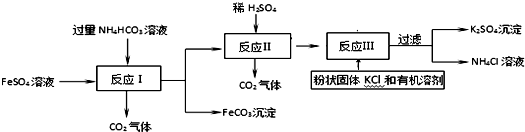
已知硫酸钾在不同温度下在水溶液、氨溶液中的溶解度(g)
| 温度(℃) | 0 | 10 | 26 | 30 |
| 水溶液 | 7.31 | 9.28 | 11.03 | 12.98 |
| 氨(8%)溶液 | 1.41 | 1.58 | 2.25 | 3.36 |
| 氨(35%)溶液 | 0.44 | 0.75 | 0.82 | 非常压 |
(2)沉淀池中氨水浓度常常控制在25%至40%,其原因是氨水浓度越大,硫酸钾溶解度越小,沉淀池温度适宜保持
低温(选填“低温”或“高温”).
(3)滤液经蒸发后产生可以循环使用的气体,其化学式为NH3;滤液中的副产品氯化钙可转化成碳酸钙固体,与HNO3反应制备Ca(NO3)2•6H2O晶体,为确保制备过程中既不补充水,也无多余的水,所用硝酸溶液中溶质与溶剂的质量比为7:5.
(4)实验室进行过滤操作需要的玻璃仪器有烧杯、玻璃棒、漏斗,其中玻璃棒在稀释浓硫酸时也用到,稀释浓硫酸时用到玻璃棒的主要作用为使溶解产生的热量及时散发,防止局部过热而引起液体飞溅.
(5)检验沉淀是否洗净的试剂是AB(填序号)
A.酚酞试液 B碳酸钠溶液 C氯化钡溶液
(6)烟气脱硫能有效减少二氧化硫的排放,能将其转化为石膏(CaSO4•2H2O)等产品,实现“变废为宝”.二氧化硫的排放会导致的环境问题是形成酸雨,可用高锰酸钾溶液检验烟气中二氧化硫.
(7)某电厂用煤200吨(含硫质量分数为2.5%),若燃烧时煤中的硫全部转化成二氧化硫,烟气脱硫中有96%的硫转化为石膏(CaSO4•2H2O),则可生产石膏多少吨?

【阅读资料】不同金属氢氧化物可以在不同的 pH 范围内从溶液中沉淀析出,工业上利用调节溶液 pH 的方法,使金属氢氧化物依次沉淀,结合过滤等操作,进行物质分离.
表是氢氧化铁与氢氧化铜开始沉淀与沉淀完全的 pH
| Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀的 pH | 1.9 | 4.7 |
| 沉淀完全的 pH | 3.2 | 6.7 |
(2)实验中,步骤 d 加稀盐酸前,因缺少洗涤(填操作名称),而使获得的氯化铁溶液不纯.
(3)FeCl3溶液容易生成 Fe(OH)3发生变质,在保存 FeCl3溶液时,常向 FeCl3溶液中加入某种酸,以防止 FeCl3溶液变质,你认为选用C(用字母表示)最合理.
A.稀硝酸 B.稀硫酸 C.稀盐酸 D.稀醋酸.
| A. | 风力发电 | B. | 木材制桌椅 | C. | 海水晒盐 | D. | 木柴燃烧 |

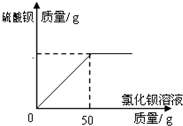 (6)现实验探究产品中硫酸钾的质量分数,取该样品10g配成溶液.滴入稍过量的质量分数为20.8%氯化钡溶液充分反应,得到的数据如下图,求样品中硫酸钾的质量分数?
(6)现实验探究产品中硫酸钾的质量分数,取该样品10g配成溶液.滴入稍过量的质量分数为20.8%氯化钡溶液充分反应,得到的数据如下图,求样品中硫酸钾的质量分数? 文文同学收集了一些家庭装修时废弃的大理石碎片,并查阅资料得知铜与稀硫酸、盐酸不反应,铁丝可以与稀硫酸和盐酸反应.于是他设计了如图的甲、乙两装置来制取二氧化碳,请回答下列问题:
文文同学收集了一些家庭装修时废弃的大理石碎片,并查阅资料得知铜与稀硫酸、盐酸不反应,铁丝可以与稀硫酸和盐酸反应.于是他设计了如图的甲、乙两装置来制取二氧化碳,请回答下列问题: