题目内容
14.纸包皮蛋是一项新技术,制作过程中需要配制料液.某配方液料中含NaOH、NaCl、红茶末、五香粉等,技术员先配得NaOH、NaCl的混合液1200g,其中含40gNaOH,40.5gNaCl.计算:(1)混合液中NaOH的质量分数为3.3%(结果精确到0.1%).
(2)如果取120g混合液,加入一定质量3.65%的稀盐酸恰好完全反应,所加稀盐酸的质量为100g;
(3)计算120g混合液与稀盐酸反应后所得溶液中NaCl的质量分数.(结果精确到0.1%)
分析 (1)已知NaOH的质量和混合液的质量根据溶质的质量分数的计算公式$\frac{溶质的质量}{溶液的质量}$×100%可求出混合液中NaOH的质量分数
(2)稀盐酸能与氢氧化钠反应根据氢氧化钠的质量和化学方程式可求出所加稀盐酸的质量
(3)根据氢氧化钠的质量和化学方程式可求出生成的氯化钠的质量,与混合液中的氯化钠的质量之和为溶质质量;
解答 解:(l)混合溶液中氢氧化钠的质量分数为 $\frac{40g}{1200g}$×100%═3.3%
(2)如果取120g混合液中氢氧化钠的质量为 $\frac{40g}{1200g}$×120g=4g
设需要稀盐酸的质量为x,生成NaCl的质量为y
NaOH+HCl═H2O+NaCl
40 36.5 58.5
4g 3.65%×x y
$\frac{40}{4g}=\frac{36.5}{3.65%×x}=\frac{58.5}{y}$
x═100g y═5.85g
(3)24g混合液与稀盐酸反应后所得溶液中NaCl的质量分数为$\frac{5.85g+\frac{40.5g}{1200g}×120g}{120g+100g}$×100%═4.5%
答:(l)混合溶液中氢氧化钠的质量分数为3.3%
(2)设需要稀盐酸的质量为100g
(3)24g混合液与稀盐酸反应后所得溶液中NaCl的质量分数为4.5%
点评 本题主要考查学生运用化学方程式进行计算和推断的能力,计算时要注意规范性和准确性,根据化学方程式进行计算时,所使用的均为纯净物的质量.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.下列除去杂质(括号内)的方法正确的是( )
| A. | CO2(CO):将气体在空气中点燃 | |
| B. | CO(CO2):将气体通过装有烧碱溶液的洗气瓶 | |
| C. | 铁粉(氧化铁):加入足量的稀盐酸 | |
| D. | Na2SO4溶液(NaOH溶液):加入适量的稀盐酸 |
2. 许多物质在溶液中都以离子形式存在.我们熟悉的复分解反应就是溶液中离子间结合得到水、气体或沉淀 的一类化学反应.如:氢氧化钠与盐酸的反应就是溶液中的H+和OH-结合成水分子的过程(如图所示).结合信息、图示,你认为下列各组离子间不能反应的是( )
许多物质在溶液中都以离子形式存在.我们熟悉的复分解反应就是溶液中离子间结合得到水、气体或沉淀 的一类化学反应.如:氢氧化钠与盐酸的反应就是溶液中的H+和OH-结合成水分子的过程(如图所示).结合信息、图示,你认为下列各组离子间不能反应的是( )
 许多物质在溶液中都以离子形式存在.我们熟悉的复分解反应就是溶液中离子间结合得到水、气体或沉淀 的一类化学反应.如:氢氧化钠与盐酸的反应就是溶液中的H+和OH-结合成水分子的过程(如图所示).结合信息、图示,你认为下列各组离子间不能反应的是( )
许多物质在溶液中都以离子形式存在.我们熟悉的复分解反应就是溶液中离子间结合得到水、气体或沉淀 的一类化学反应.如:氢氧化钠与盐酸的反应就是溶液中的H+和OH-结合成水分子的过程(如图所示).结合信息、图示,你认为下列各组离子间不能反应的是( )| A. | H+ Na+ 0H-NO3- | B. | Na+ K+Cl-OH- | ||
| C. | H+ K+CO32- HCO3- | D. | K+ Ba2+ Cl- SO42- |
6.某同学对下列4个实验都设计了两种方案,其中方案一、方案二都合理的是( )
| 选项 | A | B | C | D |
| 实验 目的 | 除去铜粉中少量的铁粉 | 检验某气体为CO2 | 鉴别硫酸钾和硝酸铵两种化肥 | 证明氯化钠溶液和稀盐酸 |
| 方案一 | 用磁铁吸引 | 带火星的木条复燃 | 看外观 | 加紫色石蕊试液 |
| 方案二 | 加稀盐酸 | 加澄清石灰水 | 加熟石灰研磨闻气味 | 加硝酸银溶液 |
| A. | A | B. | B | C. | C | D. | D |
3.铁的锈浊对社会生产造成较大损害,但也有有利的一面,如某些食品包装袋内常放入还原性铁粉作“双吸剂”以防止食品腐败.某课外兴趣小组在实验室发现了一包破损的还原性铁粉(含少量杂质,杂质既不溶于水也不溶于酸),他们取六份样品,分别加稀硫酸反应.测得部分数据加下,请根据有关信息冋答问题.
(1)食品袋内放入“双吸剂”是为了吸收O2、H2O,用铁粉而不用铁块作“双吸剂”的理由是增大与氧气、水分的接触面积,加快反应速率.
(2)a的数值为0.1.
(3)第4次实验,所得到溶液中溶质的化学式为Fe2(SO4)3、FeSO4.
(4)列式计算该样品中单质铁的质量分数(保留至0.1%).
| 实验次数 | 1 | 3 | 4 | 5 | 6 |
| 取样品质量(g) | 31.0 | 31.0 | 31.0 | 31.0 | 31.0 |
| 取稀硫酸质量(g) | 30.0 | 90.0 | 120.0 | 150.0 | 180.0 |
| 产生气体质量(g) | 0 | a | 0.3 | 0.5 | 0.6 |
(2)a的数值为0.1.
(3)第4次实验,所得到溶液中溶质的化学式为Fe2(SO4)3、FeSO4.
(4)列式计算该样品中单质铁的质量分数(保留至0.1%).
 构建知识网络是学习化学的常用方法,A~G都是初中化学中常见的物质,已知A、B、C、D、G是不同类别的物质,A俗称烧碱,D溶液中有蓝色的硫酸盐,B是光合作用的原料,E为红色粉末.它们之间的转化关系如图所示.(图中“-”表示反应,“→”表示转化关系)请回答下列问题:
构建知识网络是学习化学的常用方法,A~G都是初中化学中常见的物质,已知A、B、C、D、G是不同类别的物质,A俗称烧碱,D溶液中有蓝色的硫酸盐,B是光合作用的原料,E为红色粉末.它们之间的转化关系如图所示.(图中“-”表示反应,“→”表示转化关系)请回答下列问题: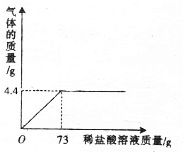 某兴趣小组为测定某混合物(碳酸钙和氯化钙)中碳酸钙的含量,取该混合物11.11g于烧杯中,向其中加入足量的稀盐酸,实验过程中,收集到的二氧化碳与反应时间关系如图所示(假设气体全部逸出).计算:
某兴趣小组为测定某混合物(碳酸钙和氯化钙)中碳酸钙的含量,取该混合物11.11g于烧杯中,向其中加入足量的稀盐酸,实验过程中,收集到的二氧化碳与反应时间关系如图所示(假设气体全部逸出).计算: