题目内容
8.化学反应有不同的分类方法.关于下列反应说法错误的是( )(1)Mg$→_{点燃}^{O_{2}}$MgO (2)MgO$\stackrel{稀H_{2}SO_{4}}{→}$MgSO4
(3)Mg$\stackrel{稀HCl}{→}$MgCl2 (4)MgCl2$\stackrel{NaOH溶液}{→}$Mg(OH)2.
| A. | (1)属于吸热反应 | B. | (3)属于置换反应 | C. | (3)属于放热反应 | D. | (4)属于复分解反应 |
分析 化学反应的类型有四个:化合反应、分解反应、置换反应和复分解反应.化合反应是有两种或两种以上的物质生成一种物质的化学反应,特征是:多变一.分解反应是一变多;置换反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的化学反应.复分解反应是两种化合物互相交换成分生成另外两种化合物的反应,物质的燃烧放出热量,金属与酸反应生成盐和氢气放出热量,酸碱中和反应放出热量.
解答 解:A、镁条燃烧放出热量,不是吸热反应,故A说法错误;
B、镁与盐酸反应生成氯化镁和氢气,属于置换反应,故B说法正确;
C、镁与盐酸反应生成氯化镁和氢气,放出热量,故C说法正确;
D、氯化镁与氢氧化钠反应生成氯化钠和氢氧化镁,属于复分解反应,故D说法正确.
故选A.
点评 解答本题关键是熟悉四大基本反应类型,知道物质的燃烧放出热量,金属与酸反应生成盐和氢气放出热量,酸碱中和反应放出热量.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
3.水是重要的资源.下列关于水的说法中,正确的是( )
| A. | 水是一种单质 | |
| B. | 过滤可除去污水中的不溶物,使污水变为纯水 | |
| C. | 净化水时,可用活性炭作杀菌剂 | |
| D. | 用肥皂水可区分硬水和软水 |
20.四氧化三铁可用于医疗器械、电子等工业.某实验兴趣小组从工厂采集废液(含FeSO4和少量ZnSO4、MgSO4),进行四氧化三铁的制备实验.
【阅读资料】
(1)25℃时,氢氧化物沉淀的pH范围如表.
(2)25℃时,Zn(OH)2可溶于pH>10.5的碱溶液.
(3)制备Fe3O4的实验流程如图:
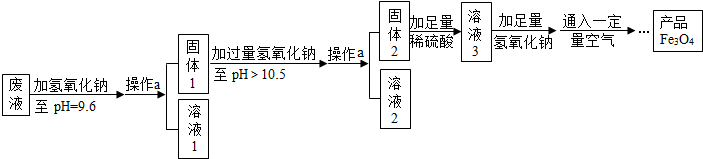
【回答问题】
(1)往废液中加入氢氧化钠溶液生成沉淀的化学方程式为(写一个即可)2NaOH+ZnSO4═Zn(OH)2↓+Na2SO4【或2NaOH+FeSO4═Fe(OH)2↓+Na2SO4】.
(2)溶液1所含溶质有(至少写两种)硫酸镁、硫酸钠;溶液3所含溶质的主要成分为硫酸亚铁.
(3)该实验取废液100g,最终得到产品四氧化三铁质量为2.32g,则原废液中硫酸亚铁溶质的质量分数不低于4.56%(精确到0.01%).
【阅读资料】
(1)25℃时,氢氧化物沉淀的pH范围如表.
| Zn(OH)2 | Fe(OH)2 | Mg(OH)2 | |
| 开始沉淀的pH | 5.7 | 7.6 | 10.4 |
| 沉淀完全的pH | 8.0 | 9.6 | 12.4 |
(3)制备Fe3O4的实验流程如图:

【回答问题】
(1)往废液中加入氢氧化钠溶液生成沉淀的化学方程式为(写一个即可)2NaOH+ZnSO4═Zn(OH)2↓+Na2SO4【或2NaOH+FeSO4═Fe(OH)2↓+Na2SO4】.
(2)溶液1所含溶质有(至少写两种)硫酸镁、硫酸钠;溶液3所含溶质的主要成分为硫酸亚铁.
(3)该实验取废液100g,最终得到产品四氧化三铁质量为2.32g,则原废液中硫酸亚铁溶质的质量分数不低于4.56%(精确到0.01%).
 用如图所示装置加热NaHCO3,试管中留下的白色固体只有Na2CO3,并观察到试管内壁有水珠生成,澄清石灰水变浑浊.根据实验回答问题.
用如图所示装置加热NaHCO3,试管中留下的白色固体只有Na2CO3,并观察到试管内壁有水珠生成,澄清石灰水变浑浊.根据实验回答问题.
 如图是甲、乙、丙三种物质的溶解度曲线.
如图是甲、乙、丙三种物质的溶解度曲线.