题目内容
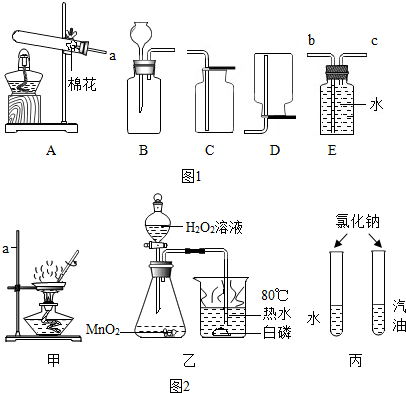
19. 用如图所示装置加热NaHCO3,试管中留下的白色固体只有Na2CO3,并观察到试管内壁有水珠生成,澄清石灰水变浑浊.根据实验回答问题.
用如图所示装置加热NaHCO3,试管中留下的白色固体只有Na2CO3,并观察到试管内壁有水珠生成,澄清石灰水变浑浊.根据实验回答问题.(1)澄清石灰水变浑浊的化学方程式为CO2+Ca(OH)2=CaCO3↓+H2O;
(2)从受热能否产生气体的角度看,焙制食品所用的发酵粉最好选择Na2CO3、NaHCO3中的NaHCO3;
(3)与加热NaHCO3相比,用大理石和稀盐酸反应制CO2的优点是大理石和稀盐酸反应产生二氧化碳是在常温下进行的,不需要加热,操作简单等(写出一点即可).
分析 (1)根据澄清的石灰水若变浑浊是因为碳酸氢钙受热分解生成的二氧化碳和石灰水反应有沉淀生成写出反应的方程式;
(2)根据实验现象分析碳酸钠和碳酸氢钠的运用;
(3)根据两个反应的特点分析.
解答 解:(1)澄清的石灰水若变浑浊是因为二氧化碳和石灰水反应生成了碳酸钙沉淀,故反应的方程式为:CO2+Ca(OH)2=CaCO3↓+H2O;
(2)碳酸氢钠能够分解产生二氧化碳,而碳酸钠不能分解,因此焙制食品所用的发酵粉最好选择NaHCO3;故填:NaHCO3;
(3)碳酸氢钠需要加热,而大理石和稀盐酸反应产生二氧化碳是在常温下进行的;故填:大理石和稀盐酸反应产生二氧化碳是在常温下进行的,不需要加热,操作简单等.
点评 此题考查的是碳酸氢钠分解的有关知识,依据题目信息结合已有的知识分析即可.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.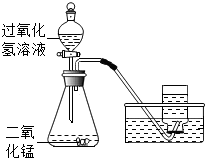 某同学在实验室用溶质质量分数为10%过氧化氢溶液和二氧化锰制取氧气,恰好完全反应,实验的相关数据如下表.
某同学在实验室用溶质质量分数为10%过氧化氢溶液和二氧化锰制取氧气,恰好完全反应,实验的相关数据如下表.
(1)反应生成氧气的质量为1.6g;
(2)计算原混合物中二氧化锰的质量,并写出必要的计算过程.
 某同学在实验室用溶质质量分数为10%过氧化氢溶液和二氧化锰制取氧气,恰好完全反应,实验的相关数据如下表.
某同学在实验室用溶质质量分数为10%过氧化氢溶液和二氧化锰制取氧气,恰好完全反应,实验的相关数据如下表.| 发生装置内物质的总质量 | |
| 反应前 | 34.3g |
| 反应后 | 32.7g |
(2)计算原混合物中二氧化锰的质量,并写出必要的计算过程.
7.对下列事实的解释,正确的是( )
| A. | 空气能被压缩-分子的体积变小 | |
| B. | 铝的抗腐蚀性比铁强-铁比铝更容易与氧气反应 | |
| C. | 浓硫酸、氢氧化钠溶液露置在空气中质量都增加-都吸收了水分 | |
| D. | 点燃所有可燃性气体前都应先验纯-防止气体不纯点燃时发生爆炸 |
14.KNO3和NaCl的溶解度如下表所示,回答下列问题.
(1)20℃时,将33g NaCl放入100g水中,充分溶解后,所得溶液为NaCl的不饱和(填“饱和”或“不饱和”)溶液;
(2)60℃KNO3的饱和溶液中含有少量的NaCl,将其降温到20℃时,一定析出的物质是硝酸钾;
(3)在溶质质量分数不变的情况下,将60℃KNO3的不饱和溶液变为饱和溶液可采用的方法是降温.
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | |
| 溶解度/g | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 |
| KCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 | |
(2)60℃KNO3的饱和溶液中含有少量的NaCl,将其降温到20℃时,一定析出的物质是硝酸钾;
(3)在溶质质量分数不变的情况下,将60℃KNO3的不饱和溶液变为饱和溶液可采用的方法是降温.
4.下列说法中,错误的是( )
| A. | 食用蔬菜、水果可补充维生素 | |
| B. | 用燃烧法可以区分天然纤维和合成纤维 | |
| C. | 将黄铜与铜相互刻划,铜表面会出现划痕 | |
| D. | 尿素[CO(NH2)2]是一种复合肥 |
8.化学反应有不同的分类方法.关于下列反应说法错误的是( )
(1)Mg$→_{点燃}^{O_{2}}$MgO (2)MgO$\stackrel{稀H_{2}SO_{4}}{→}$MgSO4
(3)Mg$\stackrel{稀HCl}{→}$MgCl2 (4)MgCl2$\stackrel{NaOH溶液}{→}$Mg(OH)2.
(1)Mg$→_{点燃}^{O_{2}}$MgO (2)MgO$\stackrel{稀H_{2}SO_{4}}{→}$MgSO4
(3)Mg$\stackrel{稀HCl}{→}$MgCl2 (4)MgCl2$\stackrel{NaOH溶液}{→}$Mg(OH)2.
| A. | (1)属于吸热反应 | B. | (3)属于置换反应 | C. | (3)属于放热反应 | D. | (4)属于复分解反应 |