题目内容
10.下列物质的用途正确的是( )| A. |  液氮冷冻机 | B. |  炭黑作冰箱除味剂 | ||
| C. |  石灰石作天安门华表 | D. |  玻璃钢制成船体 |
分析 物质的性质决定物质的用途,根据已有的物质的性质进行分析解答即可.
解答 解:A、液氮蒸发吸热,可用于制冷,正确;
B、炭黑不具有吸附性,不能作冰箱除味剂,错误;
C、石灰石硬度大,可作天安门华表,正确;
D、玻璃钢一般指用玻璃纤维增强不饱和聚脂、环氧树脂与酚醛树脂基体,以玻璃纤维或其制品作增强材料的增强塑料;玻璃钢可以代替钢材制造机器零件和汽车、船舶外壳等,正确;
故填:ACD.
点评 掌握常见的物质的性质是正确解答本题的关键.

练习册系列答案
相关题目
1.氧化镁在医药、建筑等行业应用广泛,以菱镁矿(主要成分为MgCO3,含少量FeCO3,其他杂质不溶,也不参加反应)为原料制备高纯氧化镁的实验流程如图1:

资料:①不同氢氧化物沉淀的pH范围:
②硫在常温下是一种淡黄色固体,硫的熔点约为115.2℃,沸点约为444.7℃;
③高锰酸钾溶液只吸收SO2,不吸收CO2;
④碱溶液既吸收SO2,又吸收CO2.
试回答下列问题:
(1)MgCO3与稀硫酸反应的化学方程式为MgCO3+H2SO4═MgSO4+CO2↑+H2O.
(2)加入H2O2目的是在酸性条件下将FeSO4氧化成Fe2(SO4)3,同时生成水,发生反应的化学方程式为2FeSO4+H2O2+H2SO4=Fe2(SO4)3+2H2O.
(3)加氨水调节溶液的pH约为4的目的是控制反应只生成氢氧化铁沉淀而不生成氢氧化镁沉淀,反应的化学方程式为Fe2(SO4)3+6NH3•H2O=2Fe(OH)3↓+3(NH4)2SO4.
(4)煅烧过程存在以下反应:
2MgSO4+C$\frac{\underline{\;800℃\;}}{\;}$2MgO+2SO2↑+CO2↑
MgSO4+C$\frac{\underline{\;800℃\;}}{\;}$MgO+SO2↑+CO↑
MgSO4+3C$\frac{\underline{\;800℃\;}}{\;}$MgO+S↑+3CO↑
利用如图2装置对煅烧产生的气体进行分步吸收或收集.(假设每步反应都完全进行)
①A中现象是:玻璃管壁出现黄色固体;
②B中盛放的溶液可以是d(填字母),实验现象为紫红色高锰酸钾溶液颜色褪去;
a.Ca(OH)2 溶液 b.Na2CO3 溶液 c.稀硝酸 d.KMnO4溶液
③D中收集的气体是CO(填化学式).

资料:①不同氢氧化物沉淀的pH范围:
| 氢氧化物 | Fe(OH)3 | Mg(OH)2 |
| 开始沉淀的pH | 1.5 | 8.6 |
| 完全沉淀的pH | 3.2 | 11.1 |
③高锰酸钾溶液只吸收SO2,不吸收CO2;
④碱溶液既吸收SO2,又吸收CO2.
试回答下列问题:
(1)MgCO3与稀硫酸反应的化学方程式为MgCO3+H2SO4═MgSO4+CO2↑+H2O.
(2)加入H2O2目的是在酸性条件下将FeSO4氧化成Fe2(SO4)3,同时生成水,发生反应的化学方程式为2FeSO4+H2O2+H2SO4=Fe2(SO4)3+2H2O.
(3)加氨水调节溶液的pH约为4的目的是控制反应只生成氢氧化铁沉淀而不生成氢氧化镁沉淀,反应的化学方程式为Fe2(SO4)3+6NH3•H2O=2Fe(OH)3↓+3(NH4)2SO4.
(4)煅烧过程存在以下反应:
2MgSO4+C$\frac{\underline{\;800℃\;}}{\;}$2MgO+2SO2↑+CO2↑
MgSO4+C$\frac{\underline{\;800℃\;}}{\;}$MgO+SO2↑+CO↑
MgSO4+3C$\frac{\underline{\;800℃\;}}{\;}$MgO+S↑+3CO↑
利用如图2装置对煅烧产生的气体进行分步吸收或收集.(假设每步反应都完全进行)
①A中现象是:玻璃管壁出现黄色固体;
②B中盛放的溶液可以是d(填字母),实验现象为紫红色高锰酸钾溶液颜色褪去;
a.Ca(OH)2 溶液 b.Na2CO3 溶液 c.稀硝酸 d.KMnO4溶液
③D中收集的气体是CO(填化学式).
18.如图所示实验设计与对应的实验目的表述不一致的是( )
| A. | 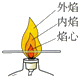 比较火焰各层温度 | B. | 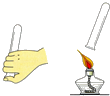 检验氢气纯度 | ||
| C. |  验证CO2的密度比空气大 | D. | 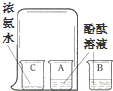 探究分子运动对温度的影响 |
5.以黄铜矿(主要成分是CuFeS2,含少量杂质SiO2)为原料炼铜的方法分为高温炼铜和湿法炼铜两种.近年来,湿法炼铜有了新进展.科学家发现有一种细菌在酸性水溶液、氧气存在下,可以将黄铜矿氧化成硫酸盐,反应方程式如下:(4CuFeS2+2H2SO4+17O2═4CuSO4+2Fe2(SO4)3+2H2O),某工厂运用该原理生产铜和绿矾(FeSO4的晶体,含结晶水).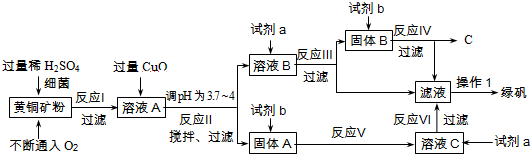
资料:①部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如表:
②在溶液中,存在反应:Fe2(SO4)3+Fe═3FeSO4
回答下列问题:
(1)溶液A的成分为H2SO4、CuSO4、Fe2(SO4)3(写化学式),试剂b为稀硫酸;
(2)反应Ⅱ中加CuO调pH为3.7~4的目的是使Fe3+形成Fe(OH)3沉淀,防止生成Cu(OH)2沉淀;
(3)反应Ⅲ的化学方程式CuSO4+Fe=Cu+FeSO4;
(4)欲从溶液中获得绿矾晶体,分离操作Ⅰ应为蒸发浓缩、冷却结晶、过滤.

资料:①部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如表:
| 沉淀物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 4.7 | 2.7 | 7.6 |
| 完全沉淀pH | 6.7 | 3.7 | 9.6 |
回答下列问题:
(1)溶液A的成分为H2SO4、CuSO4、Fe2(SO4)3(写化学式),试剂b为稀硫酸;
(2)反应Ⅱ中加CuO调pH为3.7~4的目的是使Fe3+形成Fe(OH)3沉淀,防止生成Cu(OH)2沉淀;
(3)反应Ⅲ的化学方程式CuSO4+Fe=Cu+FeSO4;
(4)欲从溶液中获得绿矾晶体,分离操作Ⅰ应为蒸发浓缩、冷却结晶、过滤.
20.下列关于科学知识应用的说法中正确的是( )
| A. | 霉变的大米用水多次清洗后食用 | |
| B. | 煤炉边放一盆水,防止煤气中毒 | |
| C. | 使用省力杠杆也可以省距离 | |
| D. | 雨天,机动车低速行驶的原因是车轮与地面的摩擦较小 |


