题目内容
某化学兴趣小组以“金属与酸溶液、盐溶液发生置换反应的规律”为课题,进行下面探究活动:
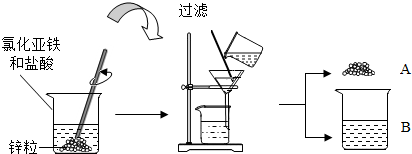
【提出问题】滤渣和滤液的成分是什么
【实验分析】滤渣A的成分中一定含有 ,发生反应的方程式
【交流与评价】小明认为废液B中一定没有盐酸,其理由是
【反思与结论】小红反思后完成了下面实验,于是得出了滤液B成分
【实验拓展】若废液中含有两种溶质,想得到纯净的氯化锌固体,你的实验方案 .

【提出问题】滤渣和滤液的成分是什么
【实验分析】滤渣A的成分中一定含有
【交流与评价】小明认为废液B中一定没有盐酸,其理由是
【反思与结论】小红反思后完成了下面实验,于是得出了滤液B成分
【实验拓展】若废液中含有两种溶质,想得到纯净的氯化锌固体,你的实验方案
考点:金属的化学性质,书写化学方程式、文字表达式、电离方程式
专题:金属与金属材料
分析:【实验分析】锌和稀盐酸反应生成氯化锌和氢气;由于金属活动顺序表中锌排在铁的前面,则锌可以和氯化亚铁反应生成氯化锌和铁,分析解答;
【交流与评价】从锌先与盐酸反应,后与氯化亚铁反应,由于滤渣中一定存在铁,说明已经发生了锌和氯化亚铁反应分析解答;
【反思与结论】从锌和稀盐酸反应生成氯化锌和氢气;由于金属活动顺序表中锌排在铁的前面,则锌可以和氯化亚铁反应生成氯化锌和铁,如果氯化亚铁和稀盐酸完全反应,则溶液中只的氯化锌去分析解答;
【实验拓展】从若废液中含有两种溶质,则这两种物质应该是锌和稀盐酸反应生成氯化锌、锌和氯化亚铁反应生成氯化锌、及剩余的氯化亚铁;要想得到纯净的氯化锌固体,就要除去溶液中的氯化亚铁,去分析解答.
【交流与评价】从锌先与盐酸反应,后与氯化亚铁反应,由于滤渣中一定存在铁,说明已经发生了锌和氯化亚铁反应分析解答;
【反思与结论】从锌和稀盐酸反应生成氯化锌和氢气;由于金属活动顺序表中锌排在铁的前面,则锌可以和氯化亚铁反应生成氯化锌和铁,如果氯化亚铁和稀盐酸完全反应,则溶液中只的氯化锌去分析解答;
【实验拓展】从若废液中含有两种溶质,则这两种物质应该是锌和稀盐酸反应生成氯化锌、锌和氯化亚铁反应生成氯化锌、及剩余的氯化亚铁;要想得到纯净的氯化锌固体,就要除去溶液中的氯化亚铁,去分析解答.
解答:解:【实验分析】从烧杯中可能发生的反应有:锌和稀盐酸反应生成氯化锌和氢气;由于金属活动顺序表中锌排在铁的前面,则锌可以和氯化亚铁反应生成氯化锌和铁,反应的化学方程式为:Zn+FeCl2═ZnCl2+Fe;滤渣A的成分中一定含有反应生成的铁,还可能有剩余的锌;
【交流与评价】从锌先与盐酸反应,后与氯化亚铁反应,由于滤渣中一定存在铁,说明已经发生了锌和氯化亚铁反应,说明盐酸已经反应完全;
【反思与结论】从锌和稀盐酸反应生成氯化锌和氢气;由于金属活动顺序表中锌排在铁的前面,则锌可以和氯化亚铁反应生成氯化锌和铁,因为锌先与盐酸反应,后与氯化亚铁反应,滤渣中一定存在铁,盐酸一定被耗尽;
【实验拓展】从若废液中含有两种溶质,则这两种物质应该是锌和稀盐酸反应生成氯化锌、锌和氯化亚铁反应生成氯化锌、及剩余的氯化亚铁;要想得到纯净的氯化锌固体,就要除去溶液中的氯化亚铁,所以向废液中加入足量的锌粒,充分反应后过滤,将滤液蒸发结晶.
故答案为:【实验分析】Fe;Zn+FeCl2═ZnCl2+Fe;
【交流与评价】因为锌先与盐酸反应,后与氯化亚铁反应,滤渣中一定存在铁,盐酸一定被耗尽
【反思与结论】ZnCl2
【实验拓展】向废液中加入足量的锌粒,充分反应后过滤,将滤液蒸发结晶
【交流与评价】从锌先与盐酸反应,后与氯化亚铁反应,由于滤渣中一定存在铁,说明已经发生了锌和氯化亚铁反应,说明盐酸已经反应完全;
【反思与结论】从锌和稀盐酸反应生成氯化锌和氢气;由于金属活动顺序表中锌排在铁的前面,则锌可以和氯化亚铁反应生成氯化锌和铁,因为锌先与盐酸反应,后与氯化亚铁反应,滤渣中一定存在铁,盐酸一定被耗尽;
【实验拓展】从若废液中含有两种溶质,则这两种物质应该是锌和稀盐酸反应生成氯化锌、锌和氯化亚铁反应生成氯化锌、及剩余的氯化亚铁;要想得到纯净的氯化锌固体,就要除去溶液中的氯化亚铁,所以向废液中加入足量的锌粒,充分反应后过滤,将滤液蒸发结晶.
故答案为:【实验分析】Fe;Zn+FeCl2═ZnCl2+Fe;
【交流与评价】因为锌先与盐酸反应,后与氯化亚铁反应,滤渣中一定存在铁,盐酸一定被耗尽
【反思与结论】ZnCl2
【实验拓展】向废液中加入足量的锌粒,充分反应后过滤,将滤液蒸发结晶
点评:金属活动顺序表中前面的金属置换后面的金属时,两种金属离得越远越容易发生反应.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
下列物质中,属于纯净物的是( )
| A、洁净的空气 | B、合金 |
| C、液态氧 | D、水泥砂浆 |
 下面是利用如图装置完成验证二氧化碳性质的实验.
下面是利用如图装置完成验证二氧化碳性质的实验.

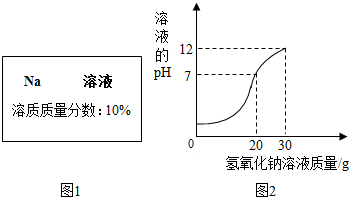 实验室有一瓶试剂,密封完好但标签残缺(如图1所示),已知它可能是NaCl,NaOH,Na2CO3,NaHCO3中的一种.
实验室有一瓶试剂,密封完好但标签残缺(如图1所示),已知它可能是NaCl,NaOH,Na2CO3,NaHCO3中的一种.