题目内容
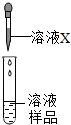
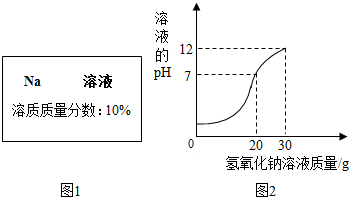 实验室有一瓶试剂,密封完好但标签残缺(如图1所示),已知它可能是NaCl,NaOH,Na2CO3,NaHCO3中的一种.
实验室有一瓶试剂,密封完好但标签残缺(如图1所示),已知它可能是NaCl,NaOH,Na2CO3,NaHCO3中的一种.(1)根据受损标签的情况判断,这瓶试剂不可能是下列中的
A、酸 B、碱 C、盐
(2)某兴趣小组的同学进行了如下探究:
【查阅资料】I、Na2CO3和NaHCO3溶液都呈碱性
Ⅱ、室温(20℃)时四种物质的溶解度数据如表:
| 物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
| 溶解度/g | 36 | 109 | 21.5 | 9.6 |
【继续探究】a.取少量该试剂滴入酚酞溶液中,酚酞变红色,则该溶液的pH
b.为了确定该溶液是哪种试剂,他又进行了如表实验:
| 实验步骤 | 实验现象 | 结论及化学方程式 |
| 取样于试管中,滴加 | 产生大量气泡 | 该溶液是 化学方程式为 |
考点:缺失标签的药品成分的探究,溶质的质量分数、溶解性和溶解度的关系,有关溶质质量分数的简单计算,溶液的酸碱性与pH值的关系,盐的化学性质,常见的氧化物、酸、碱和盐的判别,根据化学反应方程式的计算
专题:科学探究
分析:交流讨论】酸是由氢离子和酸根离子构成,不可能含有钠离子;
【得出结论】根据III中所给数据可以求出在20℃时各物质的饱和溶液的质量分数,可以做出判断;
【设计实验并继续探究】(1)氯化钠溶液呈中性,pH等于7;
(2)根据碳酸钠可以和盐酸反应可以设计实验来验证碳酸钠的存在;
根据硫酸的质量计算氢氧化钠的质量,从而计算氢氧化钠的质量分数
【得出结论】根据III中所给数据可以求出在20℃时各物质的饱和溶液的质量分数,可以做出判断;
【设计实验并继续探究】(1)氯化钠溶液呈中性,pH等于7;
(2)根据碳酸钠可以和盐酸反应可以设计实验来验证碳酸钠的存在;
根据硫酸的质量计算氢氧化钠的质量,从而计算氢氧化钠的质量分数
解答:解:【交流讨论】酸当中不可能含有钠离子,故该溶液不可能是酸,故本题答案为:A;
【得出结论】根据计算可以知道在20℃时饱和碳酸氢钠的质量分数为
×100%=8.8%<10%,所以能够排除碳酸氢钠,故本题答案为:NaHCO3;
【设计实验并继续探究】
(1)小强用洁净的玻璃棒蘸取该溶液滴在pH试纸上,测得pH>7,而氯化钠溶液呈中性,pH等于7所以不可能是氯化钠,故本题答案为:NaCl
(2)小强为了检验该溶液是NaOH溶液还是Na2CO3溶液,他又进行了如下实验:根据碳酸钠可以和盐酸反应可以设计实验来验证碳酸钠的存在,如果产生气泡,则说明是碳酸钠,反之为氢氧化钠,故本题答案为:
解:设氢氧化钠的质量为x.
2NaOH+H2SO4=Na2SO4+2H2O (1分)
80 98
x 49 g×10%
80:98=x:49 g×10%
x=4 g (1分)
氢氧化钠溶液中溶质的质量分数为:
×100%=20% (1分)
答:氢氧化钠溶液中溶质的质量分数为20%.
故答案为:(1)A (1分)
(2)【得出结论】NaHCO3(1分)
【设计实验】
a.>(1分) NaCl (1分)
b.稀盐酸或稀硫酸(1分) Na2CO3 (1分)
Na2CO3+2HCl═2NaCl+H2O+CO2↑或Na2CO3+H2SO4═Na2SO4+H2O+CO2↑(1分)
(3)解:设氢氧化钠的质量为x.
2NaOH+H2SO4=Na2SO4+2H2O (1分)
80 98
x 49 g×10%
80:98=x:49 g×10%
x=4 g (1分)
氢氧化钠溶液中溶质的质量分数为:
×100%=20% (1分)
答:氢氧化钠溶液中溶质的质量分数为20%.
【得出结论】根据计算可以知道在20℃时饱和碳酸氢钠的质量分数为
| 9.6g |
| 9.6g+100g |
【设计实验并继续探究】
(1)小强用洁净的玻璃棒蘸取该溶液滴在pH试纸上,测得pH>7,而氯化钠溶液呈中性,pH等于7所以不可能是氯化钠,故本题答案为:NaCl
(2)小强为了检验该溶液是NaOH溶液还是Na2CO3溶液,他又进行了如下实验:根据碳酸钠可以和盐酸反应可以设计实验来验证碳酸钠的存在,如果产生气泡,则说明是碳酸钠,反之为氢氧化钠,故本题答案为:
| 操作步骤 | 实验现象 | 结论及化学方程式 |
| 稀盐酸(或稀硫酸) | 碳酸钠溶液 Na2CO3+2HCl═2NaCl+H2O+CO2↑ |
2NaOH+H2SO4=Na2SO4+2H2O (1分)
80 98
x 49 g×10%
80:98=x:49 g×10%
x=4 g (1分)
氢氧化钠溶液中溶质的质量分数为:
| 4g |
| 20g |
答:氢氧化钠溶液中溶质的质量分数为20%.
故答案为:(1)A (1分)
(2)【得出结论】NaHCO3(1分)
【设计实验】
a.>(1分) NaCl (1分)
b.稀盐酸或稀硫酸(1分) Na2CO3 (1分)
Na2CO3+2HCl═2NaCl+H2O+CO2↑或Na2CO3+H2SO4═Na2SO4+H2O+CO2↑(1分)
(3)解:设氢氧化钠的质量为x.
2NaOH+H2SO4=Na2SO4+2H2O (1分)
80 98
x 49 g×10%
80:98=x:49 g×10%
x=4 g (1分)
氢氧化钠溶液中溶质的质量分数为:
| 4g |
| 20g |
答:氢氧化钠溶液中溶质的质量分数为20%.
点评:本题综合利用了物质的组成、物质的溶解性、溶液的酸碱性及物质的变化规律对未知物质进行鉴别,还考查学生利用化学方程式和溶质质量分数公式进行计算的能力,难度不大,可依据相关物质的性质逐渐分析得出结论.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列应用与化学方程式、基本反应类型都正确的是( )
| A、治疗胃酸过多症 2HCl+Ca(OH)2=CaCl2+2H2O 中和反应 |
| B、铁与稀硫酸反应制氯气 2Fe+3H2SO4=Fe2(SO4)3+3H2↑ 置换反应 |
| C、雨水呈酸性的原因 CO2+H2O=H2CO3 化合反应 |
| D、吸收二氧化气体 CO2+2NaOH=Na2CO3+H2O 复分解反应 |
下列变化属于化学变化的是( )
| A、矿石炼铁 | B、蔗糖溶解 |
| C、水分蒸发 | D、盐酸挥发 |
 溶液不是NaNO3,为确定其成分,某同学进行如下研究.
溶液不是NaNO3,为确定其成分,某同学进行如下研究.
 丹丹和东东两位同学在阅读教材中的【查阅资料】草木灰的主要成分是碳酸钾,碳酸钾的化学性质和碳酸钠的化学性质相似.
丹丹和东东两位同学在阅读教材中的【查阅资料】草木灰的主要成分是碳酸钾,碳酸钾的化学性质和碳酸钠的化学性质相似.