题目内容
11.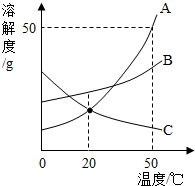 A.B.C两种固体的液解度曲线如图所示,回答问题:
A.B.C两种固体的液解度曲线如图所示,回答问题:①50℃时,三物质的溶解度由大到小的顺序是A>B>C.
②把A从饱和溶液中结晶析出的方法是降温结晶.
③50℃时,把30gA加入50 g水中,充分溶解,得到该温度下溶液的质量为75g.
④把20℃的A.C的饱和溶液升高温度后,两者溶液中溶质的质量分数的大小关系是A>C.
分析 根据题目信息和溶解度曲线可知:A、B两种固体物质的溶解度,都是随温度升高而增大,而C的溶解度随温度的升高而减少;50℃时,三物质的溶解度由大到小的顺序是A>B>C;把A从饱和溶液中结晶析出的方法是降温结晶,因为A的溶解度受温度的影响变化比较大;50℃时,A的溶解度是50g,把30gA加入50g水中,充分溶解,得到该温度下溶液的质量=25g+50g=75g;把20℃的A、C的饱和溶液升高温度后,两者溶液中溶质的质量分数的大小关系是A>C,因为升温后C有固体析出.
解答 解:(1)50℃时,三物质的溶解度由大到小的顺序是A>B>C;故答案为:A>B>C;
(2)把A从饱和溶液中结晶析出的方法是降温结晶,因为A的溶解度受温度的影响变化比较大,故答案为:降温结晶;
(3)50℃时,A的溶解度是50g,把30gA加入50g水中,充分溶解,得到该温度下溶液的质量=25g+50g=75g;故答案为:75;
(4)把20℃的A、C的饱和溶液升高温度后,两者溶液中溶质的质量分数的大小关系是A>C,因为升温后C有固体析出,故答案为:A>C;
点评 本考点考查了溶解度曲线及其应用,通过溶解度曲线我们可以获得很多信息;还考查了有关溶液的计算、结晶的方法等,有关的计算要准确,本考点主要出现在选择题和填空题中.

练习册系列答案
相关题目
2.某化工厂排放的污水中可能含有氯化钠、硫酸钠、碳酸钠.某中学兴趣小组从污水中取样想对其成分进行验证:
(1)若要用pH试纸测定该河水的酸碱度其正确的操作方法用玻璃棒取待测液滴在PH试纸上,所显示的颜色与标准比色卡对照
(2)要证明污水中是否含有氯化钠、硫酸钠、碳酸钠,写出简单的验证方案如表.
(1)若要用pH试纸测定该河水的酸碱度其正确的操作方法用玻璃棒取待测液滴在PH试纸上,所显示的颜色与标准比色卡对照
(2)要证明污水中是否含有氯化钠、硫酸钠、碳酸钠,写出简单的验证方案如表.
| 实验步骤 | 实验现象 | 结论 |
| ①取样加入足量硝酸溶液 ②取步骤1中反应后的溶液加足量的硝酸钡溶液 ③过滤 ④在滤液中,滴加硝酸银溶液 | 有气泡 有白色沉淀 白色沉淀 | 含有碳酸钠 含有硫酸钠 含有氯化钠 |
19.如表是二氧化锰用量与一定质量氯酸钾制取氧气反应速率关系的实验数据
(1)据如表可知二氧化锰与氯酸钾的质量比为$\frac{1}{10}$时,反应速率最快;
(2)通过分析可知,在化学反应中催化剂的用量不是越多越好.(填“是”或“不是”)
(3)二氧化锰用量过多冲淡了氯酸钾粉末,相当于减少反应物的质量分数,所以反应速率受到影响;
(4)二氧化锰的用量过少时产生氧气的速率很慢,原因是MnO2与KClO3的接触面积小,因此催化作用不明显.
| 二氧化锰与氯酸钾的质量比 | 1:40 | 1:20 | 1:10 | 1:5 | 1:3 | 1:2 | 2:3 | 1:1 | 2:1 |
| 生成1L氧气所需的时间(s) | 124 | 79 | 50 | 54 | 75 | 93 | 106 | 153 | 240 |
(2)通过分析可知,在化学反应中催化剂的用量不是越多越好.(填“是”或“不是”)
(3)二氧化锰用量过多冲淡了氯酸钾粉末,相当于减少反应物的质量分数,所以反应速率受到影响;
(4)二氧化锰的用量过少时产生氧气的速率很慢,原因是MnO2与KClO3的接触面积小,因此催化作用不明显.
6.下列各组分别加入足量的水中,能得到无色透明溶液的是( )
| A. | CuSO4 HCl KOH | B. | NaCl H2SO4 AgNO3 | ||
| C. | HNO3 KCl Na2SO4 | D. | Na2CO3 CaCl2 KCl |
20.下列变化中,属于物理变化的是( )
| A. | 煤气燃烧 | B. | 钢铁生锈 | C. | 葡萄酿酒 | D. | 酒精挥发 |


 是硒的原子结构示意图,硒元素位于元素周期表的4周期、6主族.
是硒的原子结构示意图,硒元素位于元素周期表的4周期、6主族. 有五种化合物,它们两两之间发生的某些转化关系如图箭头所示.请回答:
有五种化合物,它们两两之间发生的某些转化关系如图箭头所示.请回答: