题目内容
15.如图为元素周期表第三周期的一部分.据此判断下列说法中正确的是( )| 11 Na 22.99 | 12 Mg 24.31 | 13 Al 26.98 | 14 Si 28.09 |
| A. | Al的相对原子质量是26.98g | |
| B. | Si的元素名称是硅,其核电荷数为14 | |
| C. | 镁元素的相对原子质量为l2 | |
| D. | 它们都属于金属元素 |
分析 A.根据相对原子质量是有单位的,其单位为“1”,铝元素的相对原子质量质量是26.98进行解答;
B.根据元素周期表提供的信息进行判断;
C.根据元素周期表提供的信息进行判断;
D.Si元素属于非金属元素;
解答 解:A.相对原子质量是有单位的,其单位为“1”,铝元素的相对原子质量质量是26.98,故A错误;
B.根据元素周期表提供的信息,可知Si元素的名称是硅,其核电荷数为14,故正确;
C.根据元素周期表提供的信息,可知镁元素的相对原子质量为24.31,故错误;
D.Si元素属于非金属元素,故说法错误;
故选B.
点评 本题考查学生对元素周期表、核外电子层排布知识的理解及在解题中应用的能力.

练习册系列答案
相关题目
6.同学们用碳酸钠溶液和盐酸的反应验证质量守恒定律,实验后他们对残留废液的成分进行探究.
【推理假设】上述两种物质发生反应的化学方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑,由此推测出废液中一定有NaCl,可能有Na2CO3或盐酸.
【实验探究】(1)确定废液中是否含有盐酸:
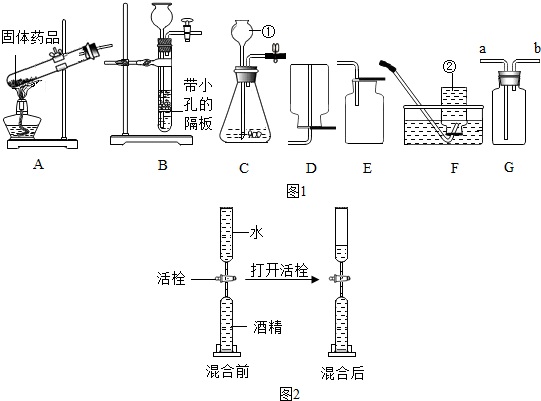
①选择试剂:根据盐酸的化学性质,同学们选用了如图所示的五种物质,其中物质X是酸碱指示剂中的石蕊溶液.
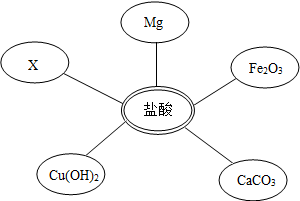
②实验验证:某同学向废液中加入少量的镁粉,观察到无气泡产生(或无现象或无变化),确定废液中一定没有盐酸.
(2)确定废液中是否含有Na2CO3:某同学选用pH试纸(或pH计)测出废液的pH=l0,确定废液中一定含有Na2CO3.
(3)处理废液,回收利用:欲从废液中得到纯净的NaCl,请完成如下实验方案设计.
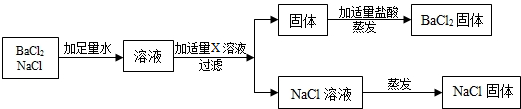
(4)拓展运用:按如图方案分离BaCl2和NaCl的固体混合物时,X溶液中溶质是Na2CO3.相关反应方程式如下Na2CO3+BaCl2=BaCO3↓+2NaCl;BaCO3+2HCl=BaCl2+H2O+CO2↑.
【推理假设】上述两种物质发生反应的化学方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑,由此推测出废液中一定有NaCl,可能有Na2CO3或盐酸.
【实验探究】(1)确定废液中是否含有盐酸:
①选择试剂:根据盐酸的化学性质,同学们选用了如图所示的五种物质,其中物质X是酸碱指示剂中的石蕊溶液.

②实验验证:某同学向废液中加入少量的镁粉,观察到无气泡产生(或无现象或无变化),确定废液中一定没有盐酸.
(2)确定废液中是否含有Na2CO3:某同学选用pH试纸(或pH计)测出废液的pH=l0,确定废液中一定含有Na2CO3.
(3)处理废液,回收利用:欲从废液中得到纯净的NaCl,请完成如下实验方案设计.
| 方案 | 加入试剂 | 提纯的方法 | 方案评价 |
| 一 | 适量Ca(NO3)2溶液 | 过滤、蒸发结晶 | (选填可行或不可行) |
| 二 | 稍过量的盐酸(或稀HCl或HCl) | 蒸发结晶 | 可行 |

5.C26H26的分子结构简式如图,帮被称为“小狗烯”,下列说法正确的是( )
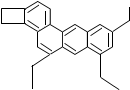

| A. | “小狗烯”属于氧化物 | |
| B. | “小狗烯”由碳、氢、氧三种元素组成 | |
| C. | “小狗烯”中碳元素的质量分数为92.3% | |
| D. | “小狗烯”中碳、氢元素的质量比为1:1 |