题目内容
7.酸、碱、盐是初中化学学习的重要内容,某研究性学习小组对“氯碱工业”生产的烧碱样品中碳酸钠的质量分数进行如下探究(提示:碱石灰成分为CaO和NaOH),请回答下列问题: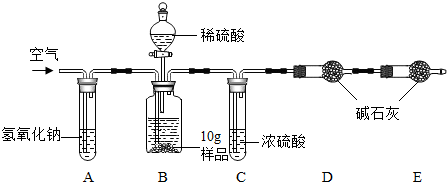
(1)写出装置A中化学反应的化学方程式2NaOH+CO2=Na2CO3+H2O;
(2)在滴加稀硫酸时,为什么要滴加到不再产生气泡为止保证将样品中的碳酸钠反应完,使测量结果更准确;
(3)装置C的作用是干燥二氧化碳,如果不用装置C会导致实验结果偏大(填“大”、“小”或“不变”).
(4)本实验通过碱石灰增重测定CO2的质量,要称量的装置是D(填D或E或D、E).
(5)学习小组的同学想检验上述工艺中的烧碱溶液里是否含有碳酸钠,甲同学用滴加酚酞溶液的方法进行检验,请你回答是否可行的原因.
(6)乙同学选择了一种溶液,不仅能够检验而且还能够除去碳酸钠,请你为乙同学写出反应的方程式.
(7)工业上常用纯碱和石灰石为原料制备烧碱,首先需要将含碳酸钙的石灰石制成熟石灰,现工厂要制得7.4t的熟石灰,需要含80%的碳酸钙的石灰石质量是多少?
分析 (1)根据氢氧化钠和二氧化碳反应生成碳酸钠和水进行分析;
(2)根据碳酸钠会与稀硫酸反应,滴加到不再产生气泡,是使碳酸钠全部参加反应进行分析;
(3)根据浓硫酸具有吸水性,碱石灰也具有吸水性进行分析;
(4)根据测定氢氧化钠中碳酸钠的含量需要测定生成二氧化碳的质量进行分析;
(5)根据碳酸钠和氢氧化钠在溶液中都显碱性,都能是酚酞变红色进行分析;
(6)根据氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠进行分析;
(7)根据化学方程式找出反应物之间的关系式,依据题中的数据进行计算.
解答 解:(1)氢氧化钠和二氧化碳反应生成碳酸钠和水,化学方程式为:2NaOH+CO2=Na2CO3+H2O;
(2)在滴加稀硫酸时,要滴加到不再产生气泡为止,原因是:保证将样品中的碳酸钠反应完,使测量结果更准确;
(3)浓硫酸具有吸水性,碱石灰也具有吸水性,所以装置C的作用是干燥二氧化碳,如果不用装置C,水蒸气会进入装置D中,会导致实验结果偏大;
(4)反应中产生的二氧化碳被D装置中的碱石灰吸收,故需要测定D装置的质量,E装置是吸收空气中二氧化碳和水蒸气的,故选:D;
(5)碳酸钠和氢氧化钠在溶液中都显碱性,都能是酚酞变红色,所以不能用滴加酚酞溶液的方法进行检验;
(6)氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,化学方程式为:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
(7)设需要含80%碳酸钙的石灰石质量为x
因为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,CaO+H2O=Ca(OH)2,可知
CaCO3-----CaO------Ca(OH)2,
100 74
x×80% 7.4t
$\frac{100}{x×80%}$=$\frac{74}{7.4t}$
x=12.5t
故答案为:(1)2NaOH+CO2=Na2CO3+H2O;
(2)保证将样品中的碳酸钠反应完,使测量结果更准确;
(3)干燥二氧化碳,大;
(4)D;
(5)碳酸钠和氢氧化钠在溶液中都显碱性,都能是酚酞变红色;
(6)Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
(7)需要含80%碳酸钙的石灰石质量为12.5t.
点评 本题主要是利用碳酸钠和硫酸反应生成了二氧化碳,依据碱石灰增加的质量就是二氧化碳的质量,通过化学方程式计算出碳酸钠的质量,进而计算碳酸钠的质量分数.

| 物 质 | a | b | c | d |
| 反应前质量/g | 6.4 | 3.2 | 4.0 | 0.5 |
| 反应后质量/g | 待测 | 2.56 | 7.2 | 0.5 |
| A. | a和b是反应物,d可能是催化剂 | |
| B. | 反应后a的质量为2.56g | |
| C. | c物中元素的种类,一定等于a、b、两种物质中元素的种类 | |
| D. | 若a与b的相对分子质量之比为2:1,则反应中a与b的化学计量数之比为1:2 |
探究Ⅰ:证明氢氧化钠溶液与稀盐酸确实能发生反应.
【方案1】测定稀盐酸与NaOH溶液混合前后的pH.
测定某NaOH溶液的pH,pH大于7.将一定量的稀盐酸加入该NaOH溶液中,混合均匀后测定其pH,发现pH减小了,但仍然大于7,小组中有的同学认为根据这个测定结果可以认为稀盐酸与NaOH溶液发生了反应,你认为他们的结论是否正确:不正确,理由滴加的盐酸中含水,加入后使NaOH溶液变稀,同样会使溶液碱性减弱,pH减小.经过讨论后,他们向溶液中又加入一定量的稀盐酸,混合均匀后测定其pH,pH小于7.
结论:稀盐酸与氢氧化钠溶液发生了化学反应,并且稀盐酸过量.
【方案2】借助于无色酚酞试液.
【药品仪器】(如图1)
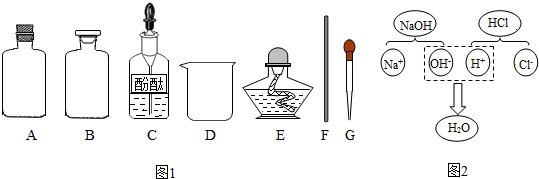
①取A(选填“A”或“B”)中试剂加入至D中,滴加2滴酚酞试液,溶液呈红色;
②用胶头滴管向①中溶液滴加稀盐酸,红色消失;
③用F蘸取②中溶液,在酒精灯上灼烧,有白色固体产生.
【思考拓展】
(1)如不使用酸碱指示剂,进一步确认步骤③中的白色固体不是氢氧化钠的方法是:取②中溶液,向其中滴加硫酸铜溶液,无蓝色沉淀
(2)探究步骤②中无色溶液中稀盐酸是否过量.
根据上述反应过程中溶液变成无色,不能确定稀盐酸是否过量,兴趣小组同学又分别选取了AgNO3溶液、紫色石蕊试液、铁粉设计实验方案,请你分析并判断:
| 实验方案 | 实验步骤 | 现 象 | 结 论 |
| ① | 取样,加入适量的AgNO3溶液 | 出现白色沉淀 | 稀盐酸过量 |
| ② | 取样,加入几滴紫色石蕊试液 | 溶液变红 | 稀盐酸过量 |
| ③ | 取样,加入少量铁粉 | 黑色固体溶解,产生气泡,溶液变浅绿色 | 稀盐酸过量 |
“②”或“③”),错误的原因是氯化钠溶液中也含Cl-,与硝酸银溶液反应也会生成白色沉淀.
请你再设计一个与上述实验不同原理的方案以确定稀盐酸是否过量,你选用的试剂是加入氧化铜或碳酸钠溶液.
(3)探究Ⅱ:从微观的角度认识物质及其变化的本质.图2表示氢氧化钠溶液与盐酸反应的微观过程,该反应的本质是H+、OH-结合生成水.
| A. | 含2个氢分子 | B. | 硼元素的化合价为+3 | ||
| C. | 只含一种非金属元素 | D. | Na、B、H的质量比为1:1:4 |
| A. | 石灰水长期存放后产生的白膜用硝酸清洗:Ca(OH)+HNO3═CaNO3+2H2O | |
| B. | 硫酸铵与烧碱混合:NH4SO4+NaOH═NaSO4+H2O+NH3↑ | |
| C. | 制取铝:3Zn+Al2(SO4)3═3ZnSO4+2Al | |
| D. | 铜表面的铜绿[Cu2(OH)2CO3]用盐酸除去:Cu2(OH)2CO3+4HCl═2CuCl2+3H2O+CO2↑ |
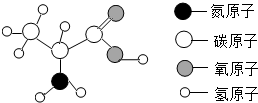 维持人类生命和健康的六大基本营养素主要有蛋白质、糖类、油脂、维生素、无机盐和水.α-丙氨酸是合成蛋白质的基础物质之一,其分子结构如图所示(注“-”表示原子之间相互连接),试计算:
维持人类生命和健康的六大基本营养素主要有蛋白质、糖类、油脂、维生素、无机盐和水.α-丙氨酸是合成蛋白质的基础物质之一,其分子结构如图所示(注“-”表示原子之间相互连接),试计算: 碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.
碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.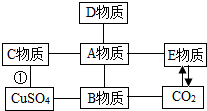 构建知识网络可以增加我们对物质化学性质的认识.如图是某同学构建的初中常见物质之间的知识网络.A、B、C、D、E是初中化学常见的不同类别的物质.它们之间有如图所示的转化和反应关系(“→”表示一种物质经一步反应可转化为另一种物质,“-”表示相连两物质能发生化学反应,部分反应物、生成物及反应条件已略去)
构建知识网络可以增加我们对物质化学性质的认识.如图是某同学构建的初中常见物质之间的知识网络.A、B、C、D、E是初中化学常见的不同类别的物质.它们之间有如图所示的转化和反应关系(“→”表示一种物质经一步反应可转化为另一种物质,“-”表示相连两物质能发生化学反应,部分反应物、生成物及反应条件已略去)