题目内容
20.如图是A、B、C三种固体物质的溶解度曲线,下列说法错误的是( )
| A. | t2℃时,A,B两种物质的溶解度相等 | |
| B. | t1℃时,195克A物质的饱和溶液中含有45克A物质 | |
| C. | 将C物质的不饱和溶液变成饱和溶液可以采取升高温度的办法 | |
| D. | 将t1℃时,A,B,C三种物质的饱和溶液升温至t2℃时,所得溶液中溶质质量分数由大到小的顺序是A=B>C |
分析 根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的.
解答 解:A、通过分析溶解度曲线可知,t2℃时,A,B两种物质的溶解度相等,故A正确;
B、t1℃时,A物质的溶解度是30g,所以195克A物质的饱和溶液中含有45克A物质,故B正确;
C、C物质的溶解度随温度的升高而减小,所以将C物质的不饱和溶液变成饱和溶液可以采取升高温度的办法,故C正确;
D、将t1℃时,A,B,C三种物质的饱和溶液升温至t2℃时,A、B不会析出晶体,C会析出晶体,所以所得溶液中溶质质量分数由大到小的顺序是B>A>C,故D错误.
故选:D.
点评 本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力.

练习册系列答案
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
10.小亮同学想通过实验探究某企业采用的氨碱法制得的纯碱样品的成分及含量.
【提出问题1】该纯碱样品中含有哪些物质?
【猜想与假设】通过分析,小亮做出如下假设:
①只含有Na2CO3;②含有Na2CO3和NaHCO3
【查阅资料】
(1)表中的现象I对应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑
(2)现象Ⅱ为有白色沉淀产生.
【实验探究】为了确定纯碱样品的成分,小亮设计如下实验方案,请你一起完成下列实验报告.
【实验反思】实验步骤①中,氯化钙溶液过量的目的是将碳酸钠全部除去
【提出问题2】如何测量该纯碱样品中各物质的含量?
(1)为测量该纯碱样品各成分的含量,小亮设计了如图1装置,通过称量B装置的质量变化来 确定样品中各成分的含量.该装置气密性良好,稀硫酸与样品、进人装置B的C02与NaOH 均完全反应,操作无误,但多次实验发现,测定结果有偏差.造成偏差的原因有①空气中的CO2进入装置B被氢氧化钠吸收;②装置A中残留的CO2未被装置B中的氢氧化钠吸收.
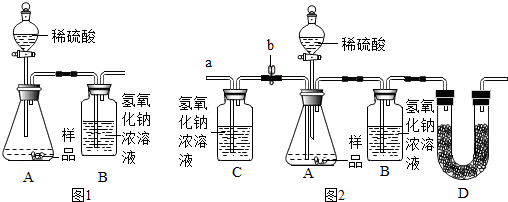
(2)小亮在老师的指导下重新设计了如图2所示的实验装置.该实验有以下操作步骤:
①检查装置气密性,将干燥的样品放人锥形瓶中;
②称量盛有氢氧化钠浓溶液的B瓶质量;
③打开活塞b,从导管a处缓缓鼓入一定量的空气,关闭活塞b;
④向锥形瓶中逐滴加人稀硫酸至不再产生气泡;
⑤再次称量盛有氢氧化钠浓溶液的B瓶质量;
⑥打开活塞b,从导管a处缓缓鼓人一定量的空气,关闭活塞b;
⑦根据B瓶增加的质量,计算样品中各成分的含量.
该实验的正确步骤是①③②④⑥⑤⑦.
【提出问题1】该纯碱样品中含有哪些物质?
【猜想与假设】通过分析,小亮做出如下假设:
①只含有Na2CO3;②含有Na2CO3和NaHCO3
【查阅资料】
| NaHCO3 | Na2CO3 | |
| 加人稀盐酸 | 现象Ⅰ | 产生气泡 |
| 加人饱和石灰水 | 溶液变浑浊 | 现象Ⅱ |
| 加人CaCl2溶液 | 无明显现象 | 溶液变浑浊 |
| 加热溶液至沸腾,将气体通入澄清石灰水 | 澄清石灰水变浑浊 | 澄清石灰水无明显变化 |
(2)现象Ⅱ为有白色沉淀产生.
【实验探究】为了确定纯碱样品的成分,小亮设计如下实验方案,请你一起完成下列实验报告.
| 实验步骤 | 实验现象 | |
| ①取少量样品溶于水,加人过量 的CaCl2溶液. | 有白色沉淀产生 | 该反应的方程式:Na2CO3+CaCl2═CaCO3↓+2NaCl |
| ②将上述反应后的混合液过滤,取滤液. | 有气泡冒出 | 证明猜想②成立. |
【提出问题2】如何测量该纯碱样品中各物质的含量?
(1)为测量该纯碱样品各成分的含量,小亮设计了如图1装置,通过称量B装置的质量变化来 确定样品中各成分的含量.该装置气密性良好,稀硫酸与样品、进人装置B的C02与NaOH 均完全反应,操作无误,但多次实验发现,测定结果有偏差.造成偏差的原因有①空气中的CO2进入装置B被氢氧化钠吸收;②装置A中残留的CO2未被装置B中的氢氧化钠吸收.

(2)小亮在老师的指导下重新设计了如图2所示的实验装置.该实验有以下操作步骤:
①检查装置气密性,将干燥的样品放人锥形瓶中;
②称量盛有氢氧化钠浓溶液的B瓶质量;
③打开活塞b,从导管a处缓缓鼓入一定量的空气,关闭活塞b;
④向锥形瓶中逐滴加人稀硫酸至不再产生气泡;
⑤再次称量盛有氢氧化钠浓溶液的B瓶质量;
⑥打开活塞b,从导管a处缓缓鼓人一定量的空气,关闭活塞b;
⑦根据B瓶增加的质量,计算样品中各成分的含量.
该实验的正确步骤是①③②④⑥⑤⑦.
8.将一定质量的铁粉加入盛有100g质量分数为16%硫酸铜溶液的烧杯中,充分反应后过滤,测得滤液的质量为99.6g.则该反应过程中,参加反应的铁的质量是( )
| A. | 5.6g | B. | 2.8g | C. | 0.4g | D. | 无法计算 |
15.饮食健康是人们普遍的生活追求,下列有关食品的说法正确的是( )
| A. | 使用甲醛浸泡海产品,保持其新鲜 | |
| B. | 在果汁中加入“塑化剂”使其口感更好 | |
| C. | 使用增白剂使馒头更好吃 | |
| D. | 在煲好的鸡汤中放入适量的加碘食盐 |
9.下列有关物质的比较推理中正确的是( )
| A. | 烧碱属于碱,故纯碱也属于碱 | |
| B. | 生铁比纯铁硬,故黄铜比纯铜硬 | |
| C. | 稀硫酸和稀盐酸是不同的酸,故化学性质完全不同 | |
| D. | 厨房洗涤剂对油污有乳化作用,故汽油对油污也有乳化作用 |
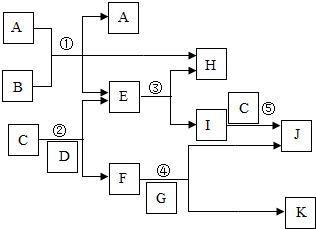 A-K都是初中化学中常见的物质,它们之间的一些转化关系如图(部分费用的条件和产物已经略去).A、C是黑色的固态氧化物,B、E是液态氧化物,F的溶液呈蓝色,F的金属元素的质量分数为40%,K的溶液呈浅绿色.请回答:
A-K都是初中化学中常见的物质,它们之间的一些转化关系如图(部分费用的条件和产物已经略去).A、C是黑色的固态氧化物,B、E是液态氧化物,F的溶液呈蓝色,F的金属元素的质量分数为40%,K的溶液呈浅绿色.请回答: