题目内容
19.将ag氯化钾溶于1.8L水中,恰使钾离子数与水分子数之比为1:100,则a值为( )| A. | 0.745 | B. | 0.39 | C. | 39 | D. | 74.5 |
分析 根据m=ρV计算水的质量,根据n=$\frac{m}{M}$计算水的物质的量,根据K+离子数与水分子数之比为1:100计算n(K+),溶液中n(K+)=n(KCl),进而计算KCl的物质的量,根据m=nM计算m(KCl).
解答 解:1.8L水的质量为1.8L×1000g/L=1800g,故水的物质的量为$\frac{1800g}{18g/mol}$=100mol,K+离子数与水分子数之比为1:100,则n(K+)=$\frac{100mol}{100}$=1mol,溶液中n(K+)=n(KCl),则m(KCl)=1mol×74.5g/mol=74.5g,
故选D.
点评 本题考查物质的量有关计算,题目基础性强,贴近教材,有利于基础知识的巩固.

练习册系列答案
相关题目
9.某无色气体可能含有H2、CO、CH4中的一种或几种,依次进行下列实验(假设每一步反应或吸收均完全):①无色气体在氧气中充分燃烧;②燃烧生成的气体通过盛浓硫酸的洗气瓶,装置质量增加10.8g;③再将剩余气体通过盛NaOH溶液的洗气瓶,装置质量增加13.2g.下列推断正确的是( )
| A. | 该气体可能含有CH4和H2 | B. | 该气体一定含有H2和CO | ||
| C. | 该气体可能含有CO和CH4 | D. | 该气体可能含有H2、CO、CH4 |
7.在托盘天平两端各放一只烧杯,调节至平衡,向烧杯里分别注入等质量、等质量分数的硫酸溶液,然后向一只烧杯里加入一定质量的镁,向另一只烧杯里加入等质量的铜铝合金,两烧杯中的反应恰好完全,且天平仍保持平衡,铜铝合金中铜与铝的质量比是( )
| A. | 1:3 | B. | 1:2 | C. | 3:4 | D. | 2:3 |
14.甲乙是某同学设计的两套制取二氧化碳的发生装置,对两套装置分析不正确的是( )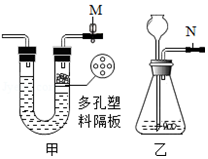

| A. | 此时甲装置中的止水夹M处于关闭状态 | |
| B. | 甲装置气体导出过程中容器内外气压相等 | |
| C. | 甲装置具有控制反应进行与否的功能 | |
| D. | 乙装置N处添加止水夹可以与甲装置具有相同功能 |
4.化学符号“2H”表示的正确的意义是( )
| A. | 2个氢分子 | B. | 2个氢原子 | C. | 2个氢元素 | D. | 2克氢元素 |
11.下表中列出了一些溶液的pH
(1)能从这些溶液中一次方便的检测出是肥皂水的试剂是石蕊试液(或无色酚酞试液)
(2)黄蜂的刺是碱性的.若你被黄蜂刺了,临时处理时,最好用上述物质中的醋涂在皮肤上来减轻疼痛.
(3)在铁罐、铝罐和塑料罐中可用于盛放保存硫酸铜溶液的是塑料罐.
| 物质 | 某种金属清洗剂 | 醋 | 硫酸铜溶液 | 肥皂水 |
| pH | 0 | 4 | 接近7 | 10 |
(2)黄蜂的刺是碱性的.若你被黄蜂刺了,临时处理时,最好用上述物质中的醋涂在皮肤上来减轻疼痛.
(3)在铁罐、铝罐和塑料罐中可用于盛放保存硫酸铜溶液的是塑料罐.
8.“硫酸铜溶液中含有铜离子、硫酸根离子和水分子等微粒,是什么微粒使硫酸铜溶液呈蓝色?”我们知道蒸馏水、硫酸钠溶液和硫酸钾溶液均为无色,由此推断使硫酸铜溶液呈蓝色的微粒是( )
| A. | 硫酸根离子 | B. | 铜离子 | ||
| C. | 水分子 | D. | 硫酸根离子和铜离子 |