题目内容
10.在一定温度下,向一定量的水中不断加入氯化钠固体,并搅拌.在此过程溶液中溶质的质量分数(b)与加入氯化钠质量(a)的变化关系如图所示,其中正确的是( )| A. | 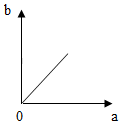 | B. | 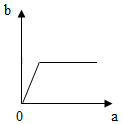 | C. |  | D. | 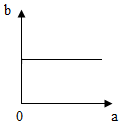 |
分析 根据溶质质量的变化和达到饱和后溶质质量不再增加来考虑本题.
解答 解:由向一定量的水中不断加入氯化钠固体,可知在加入固体前水中没有氯化钠溶质质量分数为0,随着加入氯化钠,氯化钠不断溶解,溶质质量分数不断增大,当达到饱和后,氯化钠不再溶解,所以溶质质量分数就不再增加了,观察图象,符合题意的是B,A、C、D错误.
故选B.
点评 解答本题关键是要抓住在加氯化钠前不存在氯化钠,随着加入氯化钠,溶质在不断增加,达到饱和后溶质不再溶解了.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.将ag氯化钾溶于1.8L水中,恰使钾离子数与水分子数之比为1:100,则a值为( )
| A. | 0.745 | B. | 0.39 | C. | 39 | D. | 74.5 |
20.把少量的下列物质分别放入水中,充分搅拌后,可以得到溶液的是( )
| A. | 面粉 | B. | 植物油 | C. | 汽油 | D. | 氯化钠 |
 如图是电解水的实验装置,通电后,两电极上都有气体放出.
如图是电解水的实验装置,通电后,两电极上都有气体放出.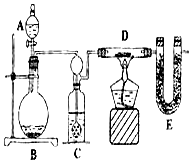 某同学为了测定水中氢、氧两元素的质量比,设计了以下实验,实验装置如图.
某同学为了测定水中氢、氧两元素的质量比,设计了以下实验,实验装置如图.