题目内容
7.溶液在生活、生产中有广泛的应用,下列有关溶液的叙述正确的是( )| A. | 均一稳定的液体一定是溶液 | B. | 洗涤剂去油污是乳化现象 | ||
| C. | 豆浆、牛奶都是溶液 | D. | 溶液都是无色的 |
分析 A、根据溶液是均一、稳定的混合物,进行分析判断.
B、根据洗涤剂具有乳化作用,进行分析判断.
C、根据溶液的本质特征是均一性、稳定性,属于混合物,进行分析判断.
D、溶液不一定都是无色的,有些溶液是带有颜色的.
解答 解:A、均一的、稳定的液体不一定是溶液,如水是均一的、稳定的液体,但不是混合物,不是溶液,故选项说法错误.
B、洗涤剂去油污,是利用了洗洁精是洗涤剂,有乳化作用,能将大的油滴分散成细小的油滴随水冲走,故选项说法正确.
C、豆浆中的营养物质有的溶于水,有的不溶于水,牛奶是不溶性的小液滴等分散到液体中形成的;豆浆、牛奶均不均一、不稳定,均不属于溶液,故选项说法错误.
D、溶液不一定都是无色的,有些溶液是带有颜色的,如硫酸铜溶液是蓝色的;故选项说法错误.
故选:B.
点评 本题难度不大,掌握溶液的本质特征(均一性、稳定性、混合物)、乳化作用等是正确解答本题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.下列关于物质的性质和用途的表述没有直接联系的是( )
| 选项 | 性质 | 用途 |
| A | 常温下碳的化学性质不活泼 | 用墨绘制字画 |
| B | 醋酸显酸性 | 用醋酸除去热水瓶中的水垢 |
| C | NaOH能与油脂反应 | 用NaOH除去油污 |
| D | CH4常温下是气体 | 用CH4作燃料 |
| A. | A | B. | B | C. | C | D. | D |
15. 为了探究石灰石的纯度(假设样品中的杂质既不溶于水也不与盐酸反应),称取40g石灰石样品等分为4份(分别编号为①、②、③、④),每份样品分别与一定量的稀盐酸反应,所得数据如表所示:
为了探究石灰石的纯度(假设样品中的杂质既不溶于水也不与盐酸反应),称取40g石灰石样品等分为4份(分别编号为①、②、③、④),每份样品分别与一定量的稀盐酸反应,所得数据如表所示:
然后,为了探究石灰石与稀盐酸反应后所得溶液中的溶质成分,将编号③所得溶液过滤,取滤液质量的$\frac{1}{4}$于烧杯中,向其中滴加质量分数为10.6%的碳酸钠溶液使其充分反应直至过量,有关的变化如图所示:
分析题中有关信息和图表,回答下列问题:
(1)该石灰石样品的纯度为80%.
(2)编号③所用稀盐酸的质量m为100g.
(3)A点处对应的溶液中溶质的质量分数是多少?(写出计算过程)
 为了探究石灰石的纯度(假设样品中的杂质既不溶于水也不与盐酸反应),称取40g石灰石样品等分为4份(分别编号为①、②、③、④),每份样品分别与一定量的稀盐酸反应,所得数据如表所示:
为了探究石灰石的纯度(假设样品中的杂质既不溶于水也不与盐酸反应),称取40g石灰石样品等分为4份(分别编号为①、②、③、④),每份样品分别与一定量的稀盐酸反应,所得数据如表所示:| 样品编号 | ① | ② | ③ | ④ |
| 稀盐酸的质量 | 25g | 50g | m(80<m<150) | 150g |
| 剩余固体的质量 | 7.5g | 5g | 2g | 2g |
分析题中有关信息和图表,回答下列问题:
(1)该石灰石样品的纯度为80%.
(2)编号③所用稀盐酸的质量m为100g.
(3)A点处对应的溶液中溶质的质量分数是多少?(写出计算过程)
2.以下实验操作正确的是( )
| A. |  加入块状固体 | B. |  加热液体 | C. |  读取液体体积 | D. |  稀释浓硫酸 |
12.下列变化属于化学变化的是( )
| A. | 酒精挥发 | B. | 水变成水蒸气 | ||
| C. | 潮湿的衣服被晒干了 | D. | 铁生锈 |
19.下列叙述不正确的是( )
| A. | 可用食醋除去热水瓶中的水垢 | B. | 在铁桶中较长时间配制硫酸铜溶液 | ||
| C. | 可用稀硫酸除去铁锈 | D. | 可用消石灰改良酸性土壤 |
19.教材回顾:相同条件下,金属单质活动性越强,其与酸溶液发生反应越剧烈.
化学学习小组在老师的帮助下对金属与稀硫酸反应情况的进行深入的实验探究.
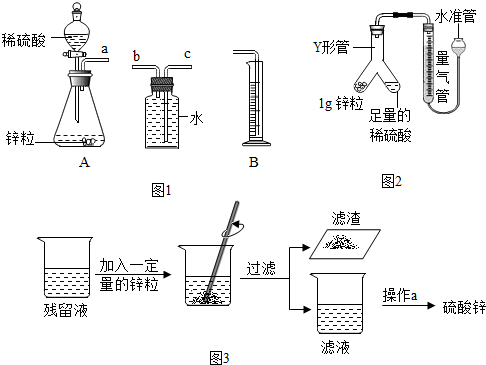
[实验探究一]影响金属锌与稀硫酸反应剧烈程度的因素有哪些?
[作出猜想]小芳同学:金属锌的形状可能影响反应剧烈程度.
小华同学:稀硫酸的溶质质量分数可能影响反应剧烈程度.
(1)锌与稀硫酸反应的化学方程式为Zn+H2SO4═ZnSO4+H2↑.
(2)反应剧烈程度体现在单位时间内反应得到氢气体积的大小.利用如图1的仪器可以组装一套实验室测量取氢气体积的装置,该装置导管的连接顺序是a→b→c→d.其中量筒的作用是由量筒内水的体积读出气体的体积.
[实验验证]某化学课外小组的同学用不同浓度的硫酸和不同形状的锌进行以下四组实验.
(3)要比较不同浓度的硫酸对反应快慢的影响,应选择的实验编号是①③或②④(填一种).
(4)比较实验①和②,可以得到的结论是锌与硫酸的接触面积越大,反应速率越快.
(5)该小组同学进行第①组实验的详细数据如表所示:
①锌与稀硫酸的反应一开始逐渐变快,产生这一现象的可能原因是该反应是放热(填“放热”“吸热”)反应,由此猜想化学反应剧烈程度还与温度有关.
②锌与稀硫酸反应第2min后开始变慢的主要原因随着硫酸被消耗,硫酸溶质质量分数变小,反应速度又逐渐减慢.
[实验探究二]如何测定锌粒(杂质不与稀硫酸反应)中锌的质量分数?
(6)提出问题:利用实验探究一的装置进行实验测出的气体体积偏大,原因是测量出的体积实际为反应产生氢气的体积与锥形瓶中原有的空气之和.
(7)针对上述问题,同学们对实验装置进行改进:利用如图2装置(固定仪器的装置已略)进行实验,可准确地测量氢气体积.
在读取量气管中液面读数的过程中,应注意AC(填字母编号).
A.读数前应上下移动水准管,待两管液面相平再读数
B.保持水准管静止,待水准管中液面不再上升时再读数
C.读数时视线与凹液面最低处相平
(8)当装置恢复至常温时,测得反应生成氢气的体积为280mL(氢气的密度为0.09g/L).根据化学方程式计算,锌粒(杂质不与稀硫酸反应)中锌的质量分数为80%.
[拓展应用]如何回收硫酸锌?
将实验探究一和二的反应残留液放于烧杯中按如图3所示实验操作流程回收硫酸锌,
请回答:
(9)加入一定量的锌粒以除去残留液中过量的稀硫酸,当观察到不再有气泡生成(填实验现象),则稀硫酸已完全反应.
(10)操作a是过滤(填操作名称).操作a中玻璃棒的作用是引流.
[归纳提升]利用金属与稀硫酸的反应情况来比较镁和锌的金属活动性强弱.
(11)设计实验方案:把表面积相等的镁和锌放到等质量、等质量分数的稀硫酸中,观察金属表面产生气泡的快慢.
化学学习小组在老师的帮助下对金属与稀硫酸反应情况的进行深入的实验探究.

[实验探究一]影响金属锌与稀硫酸反应剧烈程度的因素有哪些?
[作出猜想]小芳同学:金属锌的形状可能影响反应剧烈程度.
小华同学:稀硫酸的溶质质量分数可能影响反应剧烈程度.
(1)锌与稀硫酸反应的化学方程式为Zn+H2SO4═ZnSO4+H2↑.
(2)反应剧烈程度体现在单位时间内反应得到氢气体积的大小.利用如图1的仪器可以组装一套实验室测量取氢气体积的装置,该装置导管的连接顺序是a→b→c→d.其中量筒的作用是由量筒内水的体积读出气体的体积.
[实验验证]某化学课外小组的同学用不同浓度的硫酸和不同形状的锌进行以下四组实验.
| 实验编号 | 硫酸的浓度 (均取20mL) | 锌的形状 (均取1g) | 氢气的体积(mL) (均收集3min) |
| ① | 20% | 大颗粒 | 31.7 |
| ② | 20% | 小颗粒 | 50.9 |
| ③ | 30% | 大颗粒 | 61.7 |
| ④ | 30% | 小颗粒 | 79.9 |
(4)比较实验①和②,可以得到的结论是锌与硫酸的接触面积越大,反应速率越快.
(5)该小组同学进行第①组实验的详细数据如表所示:
| 时段 | 第1min | 第2min | 第3min | 第4min | 第5min | 第6min |
| H2的体积 | 3.1mL | 16.7mL | 11.9mL | 9.6mL | 7.6mL | 6.0mL |
②锌与稀硫酸反应第2min后开始变慢的主要原因随着硫酸被消耗,硫酸溶质质量分数变小,反应速度又逐渐减慢.
[实验探究二]如何测定锌粒(杂质不与稀硫酸反应)中锌的质量分数?
(6)提出问题:利用实验探究一的装置进行实验测出的气体体积偏大,原因是测量出的体积实际为反应产生氢气的体积与锥形瓶中原有的空气之和.
(7)针对上述问题,同学们对实验装置进行改进:利用如图2装置(固定仪器的装置已略)进行实验,可准确地测量氢气体积.
在读取量气管中液面读数的过程中,应注意AC(填字母编号).
A.读数前应上下移动水准管,待两管液面相平再读数
B.保持水准管静止,待水准管中液面不再上升时再读数
C.读数时视线与凹液面最低处相平
(8)当装置恢复至常温时,测得反应生成氢气的体积为280mL(氢气的密度为0.09g/L).根据化学方程式计算,锌粒(杂质不与稀硫酸反应)中锌的质量分数为80%.
[拓展应用]如何回收硫酸锌?
将实验探究一和二的反应残留液放于烧杯中按如图3所示实验操作流程回收硫酸锌,
请回答:
(9)加入一定量的锌粒以除去残留液中过量的稀硫酸,当观察到不再有气泡生成(填实验现象),则稀硫酸已完全反应.
(10)操作a是过滤(填操作名称).操作a中玻璃棒的作用是引流.
[归纳提升]利用金属与稀硫酸的反应情况来比较镁和锌的金属活动性强弱.
(11)设计实验方案:把表面积相等的镁和锌放到等质量、等质量分数的稀硫酸中,观察金属表面产生气泡的快慢.

